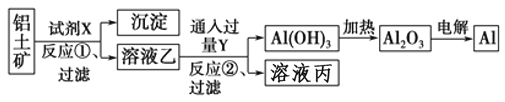
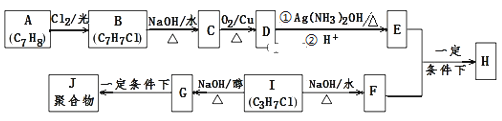
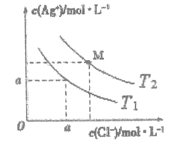
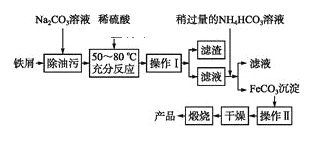
题目内容
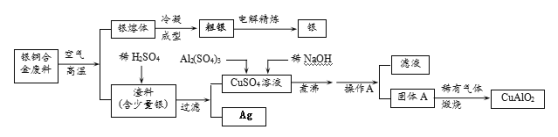
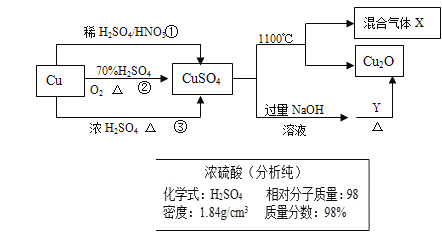
【题目】CuSO4是一种重要化工原料,其制备和有关性质如图所示。
(1)现要用如图所示的浓硫酸来配制步骤①中所需要的1mol/L的稀硫酸480ml,需要用这种浓硫酸的体积为______ml。
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒、烧杯外还有_______、__________。
(3)下列操作会使所配溶液浓度偏低的是 _________。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度 E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①②③中,途径_________能更好地体现绿色化学的思想。
(5)配制1000ml 0.1mol/L的硫酸铜溶液,需用托盘天平称取________g胆矾。
【答案】27.2 500ml容量瓶 胶头滴管 AE ② 25.0
【解析】
(1)配制1mol/L的稀硫酸480ml,需要用500ml容量瓶,因此配制稀硫酸的体积为500ml,根据图示,浓硫酸的浓度c(浓硫酸)=![]() ,设需要用这种浓硫酸的体积为Vml,根据稀释过程溶质的量不变,列关系式1mol/L×500ml=18.4mol/L×Vml,解得:V=27.2ml;
,设需要用这种浓硫酸的体积为Vml,根据稀释过程溶质的量不变,列关系式1mol/L×500ml=18.4mol/L×Vml,解得:V=27.2ml;
答案为:27.2
(2)配制该稀硫酸所用到的玻璃仪器玻璃棒、量筒、烧杯外、500ml容量瓶、胶头滴管;
答案为:500ml容量瓶、胶头滴管
(3)根据![]() 来进行分析,
来进行分析,
A. 未洗涤,所配溶液的溶质的质量减少,因此浓度减小,故A符合;
B. 未冷却至室温就转移至容量瓶,容量瓶内溶液冷却后,体积会减小,浓度偏高,故B不符合;
C. 容量瓶有无水,对实验无影响,故C不符合;
D. 定容时仰视读数,所配溶液的体积偏小,浓度增大,故D不符合;
E. 量筒含有少量的水,导致量取的溶质的体积减少,浓度减小,故E符合;
答案选AE
(4)途径①会产生有毒的一氧化氮气体,污染空气;途径②![]() ,硫酸利用率高,且不产生有污染的物质,故最好;途径③产生二氧化硫,二氧化硫有毒对环境有危害,且硫酸利用率低。
,硫酸利用率高,且不产生有污染的物质,故最好;途径③产生二氧化硫,二氧化硫有毒对环境有危害,且硫酸利用率低。
答案为:②;
(5)根据硫酸铜守恒,溶液中硫酸铜的物质的量等于胆矾中硫酸铜的物质的量,因此有![]() 。
。
答案为:25.0;

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
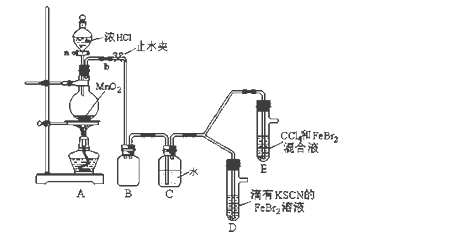
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________