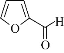
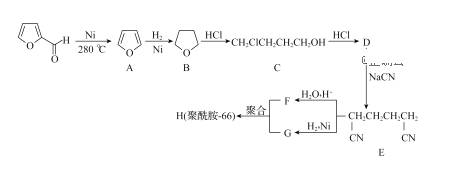
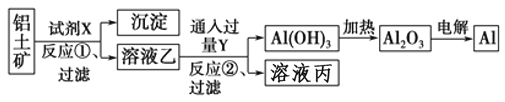
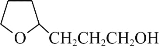题目内容
【题目】(一)现有浓度均为![]() 的盐酸、硫酸、醋酸三种溶液,回答下列问题:
的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中![]() 分别为
分别为![]() ,则它们的大小关系为_________________________________________。
,则它们的大小关系为_________________________________________。
(2)等体积的以上三种酸分别与过量的![]() 溶液反应,若生成的盐的物质的量依次为
溶液反应,若生成的盐的物质的量依次为![]() ,则它们的大小关系为__________________________。
,则它们的大小关系为__________________________。
(3)分别用以上三种酸中和一定量的![]() 溶液生成正盐,若需要酸的体积分别为
溶液生成正盐,若需要酸的体积分别为![]() ,其大小关系为__________________________________。
,其大小关系为__________________________________。
(4)分别与锌反应,开始时生成氢气的速率为![]() ,其大小关系为______________________。
,其大小关系为______________________。
(二)有![]() 四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 |
|
阴离子 |
|
已知:①![]() 溶液的
溶液的![]() 均大于7,
均大于7, ![]() 的溶液中水的电离程度相同;②
的溶液中水的电离程度相同;②![]() 溶液和
溶液和![]() 溶液相遇时只生成白色沉淀,
溶液相遇时只生成白色沉淀, ![]() 溶液和
溶液和![]() 溶液相遇时只生成刺激性气味的气体,
溶液相遇时只生成刺激性气味的气体, ![]() 溶液和
溶液和![]() 溶液混合时无现象。
溶液混合时无现象。
(1) ![]() 是_________________________,
是_________________________,![]() 是_______________________(填化学式)。
是_______________________(填化学式)。
(2)写出![]() 和
和![]() 反应的离子方程式_________________________________。
反应的离子方程式_________________________________。
(3) ![]() 时,
时, ![]() 溶液的
溶液的![]() ,则
,则![]() 溶液中
溶液中![]() _________________________________________(用含有
_________________________________________(用含有![]() 的关系式表示)。
的关系式表示)。
(4)将等体积、等物质的量浓度的![]() 溶液和
溶液和![]() 溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
(5)在一定体积的![]() 的
的![]() 溶液中,加入一定体积的
溶液中,加入一定体积的![]() 的盐酸,混合溶液的
的盐酸,混合溶液的![]() ,若反应后溶液的体积等于
,若反应后溶液的体积等于![]() 溶液与盐酸的体积之和,则
溶液与盐酸的体积之和,则![]() 溶液与盐酸的体积比是_______________。
溶液与盐酸的体积比是_______________。
【答案】![]() 或者是
或者是![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 1:4
1:4
【解析】
(一)(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离。醋酸是一元弱酸,不能完全电离,据此分析;
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同;
(3)硫酸为二元酸,盐酸与醋酸为一元酸,据此分析;
(4)生成氢气速率的大小决定于氢离子浓度的大小;
(二)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀;
(3)根据溶液中电荷守恒、物料守恒计算c(H+)-c(NH3H2O);
(4)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,根据溶液中的溶质性质确定离子浓度关系;
(5)混合溶液的pH=11,溶液显碱性,则碱过量,结合![]() =0.001计算。
=0.001计算。
(一)(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离。醋酸是一元弱酸,不能完全电离。所以浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液中,氢离子浓度分别为0.1molL-1、0.2molL-1、小于0.1molL-1,所以![]() a1=a2>a3或者是
a1=a2>a3或者是![]() ;
;
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,所以其与NaOH反应生成盐的物质的量相同,故答案为:b1=b2=b3;
(3)硫酸为二元酸,盐酸与醋酸为一元酸,分别用以上三种相同浓度的酸中和等物质的童的NaOH溶液生成正盐,需要碱液体积最少的酸为硫酸,故答案为:![]() ;
;
(4)浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,氢离子浓度分别为0.1molL-1、0.2molL-1、小于0.1molL-1,生成氢气速率的大小决定于氢离子浓度的大小,所以分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为v2>v1>v3;
(二)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,另一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,另一种溶液含有氢氧根离子。A溶液和
(1)通过以上分析知,A是CH3COONa、B是NH4Cl,故答案为:CH3COONa;NH4Cl;
(2)C是氢氧化钡、D是硫酸钠,钡离子和硫酸根离子反应生成硫酸钡沉淀,离子方程式为Ba2++SO42-=BaSO4↓;
(3)根据溶液中电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据溶液中物料守恒得 c(NH3H2O)+c(NH4+)=c(Cl-),将两个等式相减得c(H+)-c(NH3H2O)=c(OH-)=10 a-14;
(4)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,溶液中氢氧根离子浓度最大,钡离子和氯离子浓度相等,氨水是弱碱部分电离导致氯离子浓度大于铵根离子浓度,溶液呈碱性,氢离子浓度最小,所以溶液中离子浓度大小顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+);
(5)混合溶液的pH=11,溶液显碱性,则碱过量,过量c(OH-)=0.001mol/L,由C的体积为x,盐酸的体积为y,由![]() =0.001可知,
=0.001可知,![]() =0.001,解得x:y=1:4。
=0.001,解得x:y=1:4。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案