题目内容
19.化学与人类生产、生活密切相关,下列有关说法不正确的是( )| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 向海水中加入净水剂明矾可以使海水淡化 | |
| C. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
分析 A.75%的酒精为医用酒精,具有杀菌消毒作用;
B.明矾具有吸附作用,可净化海水,但不能淡化;
C.甲醛可使蛋白质变性;
D.烟花利用金属的焰色反应的性质.
解答 解:A.75%的酒精为医用酒精,可使蛋白质变性,具有杀菌消毒作用,乙醇可由淀粉类植物发酵经蒸馏制成,故A正确;
B.明矾水解生成具有吸附作用的氢氧化铝,除去水中的悬浮物,可净化海水,但不能淡化,故B错误;
C.福尔马林的主要成分为甲醛,甲醛可使蛋白质变性,可用于浸制标本,故C正确;
D.烟花利用金属的焰色反应的性质,故D正确.
故选B.
点评 本题综合考查有机物的结构和性质以及元素化合物知识,为高考常见题型,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为MnO2+SO2=SO42-+Mn2+;
(2)调pH至5-6的目的是沉淀Fe3+和Al3+,调pH至5-6所加的试剂可选择bc(填以下试剂的序号字母);
a.NaOH b.MgO c.CaO d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式MnF2+Mg2+=Mn2++MgF2,该反应的平衡常数数值为7.2×107.
(已知:MnF2的KSP=5.3×10-3; CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是Mn2++H2O=Mn(OH)2+2H+(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为c(SO42-)>c(Mn2+)>c(H+)>c(OH-).
7.从绿色化学和经济效益角度考虑,制取Cu(NO3)2最适宜采用的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
4.下列说法正确的是( )
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
11.下列化学用语正确的是( )
| A. | F-的结构示意图: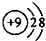 | B. | 乙烯分子比例模型: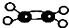 | ||
| C. | 乙酸的结构式:C2H4O2 | D. | Na2O的电子式: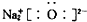 |
8.下列涉及有机物的说法正确的是( )
| A. | 冰醋酸与食用醋有相同的气味 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
9.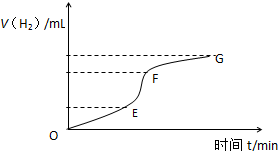 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:
(1)如图为氢气与反应时间关系图,分析判断EF段化学反应速率最快,最快的原因是该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快.
(2)某学生在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值且气体体积均转化为标准状况下体积):
求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol.L-1.min-1.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是AC.
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(4)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答一种)降低温度.
 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:(1)如图为氢气与反应时间关系图,分析判断EF段化学反应速率最快,最快的原因是该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快.
(2)某学生在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值且气体体积均转化为标准状况下体积):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是AC.
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(4)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答一种)降低温度.
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题: