题目内容
14.在反应容器中充人SO2 V1L和H2S V2L(标准状况下),充分作用后测知所得氧化产物比还原产物多1.6克,则以下推断一定错误的是( )| A. | V1>1.12 V2>2.24 | B. | Vl+V2≥3.36 | ||
| C. | 若Vl=1.12,则V2≥2.24 | D. | 若V1≥1.12,则V2=2.24 |
分析 发生反应为SO2+2H2S=2H2O+3S↓,氧化产物和还原产物都是S,1.6gS的物质的量为:$\frac{1.6g}{32g/mol}$=0.05mol;设参加反应的二氧化硫的物质的量为x,则同时消耗2x硫化氢,充分作用后测知所得氧化产物比还原产物多:2x-x=x=0.05mol,故参加反应的二氧化硫的物质的量为0.05mol,参加反应的硫化氢的物质的量为:0.05mol×2=0.1mol,
若V1>1.12、V2>2.24,参加反应的二氧化硫的物质的量大于$\frac{1.12L}{22.4L/mol}$=0.05mol;
若V1=1.12、V2≥2.24或V1≥1.12、V2=2.24时,参加反应消耗二氧化硫、硫化氢的物质的量分别为0.05mol、0.1mol,满足条件,故Vl+V2≥3.36,据此进行判断.
解答 解:发生反应为SO2+2H2S=2H2O+3S↓,氧化产物和还原产物都是S,1.6gS的物质的量为:$\frac{1.6g}{32g/mol}$=0.05mol,
设参加反应的二氧化硫的物质的量为x,则同时消耗2x硫化氢,
充分作用后测知所得氧化产物比还原产物多:2x-x=x=0.05mol,
即:参加反应的二氧化硫的物质的量为0.05mol,参加反应的硫化氢的物质的量为:0.05mol×2=0.1mol,
A.若V1>1.12、V2>2.24,参加反应的二氧化硫的物质的量大于$\frac{1.12L}{22.4L/mol}$=0.05mol,不满足条件,故A错误;
B.V1=1.12、V2≥2.24或V1≥1.12、V2=2.24时,参加反应消耗二氧化硫、硫化氢的物质的量分别为0.05mol、0.1mol,满足条件,故Vl+V2≥3.36,故B正确;
C.根据B的分析可知,若Vl=1.12,则V2≥2.24,故C正确;
D.根据B的分析可知,若V1≥1.12,则V2=2.24,故D正确;
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握讨论法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | 苯酚中羟基对苯环的影响是使苯环上氢原子都变的很活泼 | |
| B. | 酯在碱性条件下的水解生成相应的羧酸和醇 | |
| C. | 参与酯化反应的物质一定有两种 | |
| D. | 能发生银镜反应的物质不一定是醛 |
| A. | 冰的密度比水小 | B. | H2O的分解温度比H2S高得多 | ||
| C. | 液态氟化氢中有三聚氟化氢(HF) | D. | NH3的沸点比PH3高 |
| A. | 改变平衡混合物的组成 | B. | 提高反应物的平衡转化率 | ||
| C. | 以同样程度改变正逆反应速率 | D. | 增大正反应速率,降低逆反应速率 |
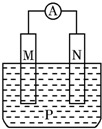 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( ) | M | N | P | |
| A | Zn | Cu | 稀H2SO4溶液 |
| B | Cu | Fe | 稀HCl溶液 |
| C | Ag | Zn | AgNO3溶液 |
| D | Zn | Fe | Fe(NO3)3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Z | B. | A-Z | C. | Z-n | D. | Z+n |
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |