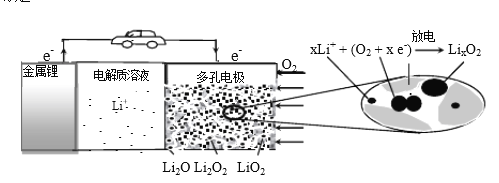
��Ŀ����
����Ŀ�����仯�����ڹ�ҵ����������������Ҫ����;��
��1����ԭ���������ӹ����ʾʽΪ__________��������Ų�ʽ��ȣ������ʾʽ�������˺�������˶�״̬�е�______��______��
��2��S��Cl��N����Ԫ�س������⻯���У�д�����ڷǵ���ʵĵ���ʽ___________����֪PbS��O2�ڸ���ʱ����Ǧ���������SO2����ѧƽ�ⳣ����K���ı���ʽΪ��K=![]() ��
��
��3��д��������Ӧ�Ļ�ѧ����ʽ__________________________����2L�����ܱ������м���PbS�����O2��0��5min��������������1.6g����5min��SO2��ƽ����Ӧ����___________________��
��4��������Ӧ�ﵽƽ���˵����ȷ����_________��ѡ���ţ���
a. ���ʹ�ϵ��2v(O2)=3v(SO2)
b. �����ܶ�����PbS���������Ӷ�����
c. ÿ����1.5molO2��ͬʱ����1molSO2
d. ѹ���������ƽ�⣬Ũ������ı�����O2>SO2

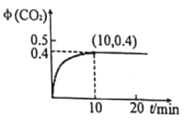
��5����NaOH��Һ�л���ͨ��SO2����������Ӧ������ij��X�����ʵ���Ũ����ͨ��SO2������仯��ͼ��ʾ������XΪ_________��SO2����ʱ��Һ���Դ�����X������ԭ��______________________
���𰸡�![]() �������������չ�������״�� ������������
�������������չ�������״�� ������������ ![]() 2PbS+3O2
2PbS+3O2![]() 2PbO+2SO2 0.01mol��L-1��min-1 ac SO32- HSO3-
2PbO+2SO2 0.01mol��L-1��min-1 ac SO32- HSO3-![]() H++SO32-������HSO3-���������������SO32-
H++SO32-������HSO3-���������������SO32-
��������
����Ԫ�����ڱ���Ԫ�������ʷ�����𣻸��ݻ�ѧ��Ӧ���ʼ���ԭ��������𣻸�����������ԭ���ڻ�ѧƽ���е�Ӧ�÷������
(1)Sԭ��λ�ڵ������ڵ�VIA�壬�����6�����ӣ���̬ԭ�Ӻ�������Ų�ʽΪ��[Ne]3s23p4,Sԭ�ӵ��������ӹ����ʾʽΪ��![]() �������ʾʽ�������˺�������˶�״̬�еĹ������������չ�������״���͵�����������
�������ʾʽ�������˺�������˶�״̬�еĹ������������չ�������״���͵�����������
�ʴ�Ϊ��![]() ���������������չ�������״����������������
���������������չ�������״����������������
(2)S��Cl��N����Ԫ�س������⻯��ֱ�Ϊ��H2S��HCl��NH3���������ڷǵ���ʵ���NH3�����ĵ���ʽΪ��![]()
(3)������Ϣ��ʾ��֪PbS��O2�ڸ���ʱ����Ǧ���������SO2������ʽΪ��2PbS+3O2![]() 2PbO+2SO2��������������1.6g��m(SO2)-m(O2)=n(SO2)��64g/mol-
2PbO+2SO2��������������1.6g��m(SO2)-m(O2)=n(SO2)��64g/mol-![]() n(SO2) ��32g/mol=1.6g������ã�n(SO2)=0.1mol��v(SO2)=
n(SO2) ��32g/mol=1.6g������ã�n(SO2)=0.1mol��v(SO2)= ![]() =
=![]() =0.01 mol��L-1��min-1��
=0.01 mol��L-1��min-1��
�ʴ�Ϊ��2PbS+3O2![]() 2PbO+2SO2��0.01mol��L-1��min-1��
2PbO+2SO2��0.01mol��L-1��min-1��
(4)��ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���![]() =
=![]() ����a��ȷ������PbS�����ı仯�Ի�ѧ��Ӧƽ��û��Ӱ�죬��b���ﵽ��ѧƽ��ʱ��v��=v��������ɵõ�ÿ����1.5molO2��ͬʱ����1molSO2����c��ȷ�����ڷ�Ӧ2PbS+3O2
����a��ȷ������PbS�����ı仯�Ի�ѧ��Ӧƽ��û��Ӱ�죬��b���ﵽ��ѧƽ��ʱ��v��=v��������ɵõ�ÿ����1.5molO2��ͬʱ����1molSO2����c��ȷ�����ڷ�Ӧ2PbS+3O2![]() 2PbO+2SO2
2PbO+2SO2
��ѹ�������SO2��Ũ������ı���һֱ��O2��Ũ������ı��������ж�ƽ�⣬��d����ѡac��
�ʴ�Ϊ��ac��
��5��SO2���������Ʒ�Ӧ����Na2SO3��SO2����������Na2SO3��Ӧ����NaHSO3����ͼ���֪��X��Ũ����������С��˵��X��SO32-������SO2����ʱ��SO2��OH-��Ӧ����HSO3-����HSO3-����Һ�д��ڵ���ƽ�⣬��HSO3-![]() H++SO32-�� HSO3-���������������SO32-��������Һ�л����SO32-��
H++SO32-�� HSO3-���������������SO32-��������Һ�л����SO32-��
�ʴ�Ϊ��SO32-�� HSO3-![]() H++SO32-������HSO3-���������������SO32-��
H++SO32-������HSO3-���������������SO32-��

 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�����Ŀ���������к���þ�����Σ�2MgO��B2O3����þ�����Σ�2MgO��SiO2��������Al2O3��FeO�����ʡ��ɸ�����ʪ���Ʊ�����þ��������ᣨH3BO3�������һ�ֹ����������£�

��֪�������������������pH���������ӵ���ʼŨ��Ϊ0.1mol/L��
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
��ʼ����ʱ | 1.9 | 3.4 | 7.0 | 9.1 |
��ȫ����ʱ | 3.2 | 4.7 | 9.0 | 11.1 |
��1�������������ܼӿ췴Ӧ���ʵĴ�ʩ��______��_______�ȡ�
��2�����ʱ������Ӧ��2MgO��SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O��2MgO��B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4��
��������Ӧ���ֳ�����ǿ����H2SO4______H3BO3���������������
�� ���ʱ��������������Al2O3��FeOҲͬʱ�ܽ⣬д����ط�Ӧ�����ӷ���ʽ��______��______��
�� ��֪���������NaOH��Һ�������кͷ�ӦΪ��H3BO3 + OH- B(OH)4-�����й��������˵����ȷ����__������ţ���
a. ������һԪ��
b. ��NaHCO3�����еμӱ���������Һ�������ݲ���
c. ����ĵ��뷽��ʽ�ɱ�ʾΪ��H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
��3�������ɫ����Һ�е��������ӣ�ȡ��������Һ��______�������������֤����Һ�к���Fe2+��
��4����ȥ����Һ�е��������ӣ� ��MgO������Һ��pH��______���ϣ�ʹ��������ת��Ϊ______���ѧʽ�����������ˡ�
��5����ȡ���壺��.Ũ����Һ��ʹMgSO4��H3BO3�ӽ����ͣ���.�����¶�ʹ���־���ֱ����Һ�нᾧ�������ͼ�ܽ�����ߣ��������ķ�������Ũ��Һ���뵽��ѹ���У�______��������������������

����Ŀ���̵���;�dz��㷺���ڸ�����ҵ�У��̵���������������90%���������ڸ�����ҵ��10%������������ɫұ�𡢻��������ӡ���ء�ũҵ�Ȳ��ţ���̼���̿���Ҫ�ɷ�ΪMnCO3�����������������ܵ�̼�������ʣ�Ϊԭ�����������̵Ĺ����������£�
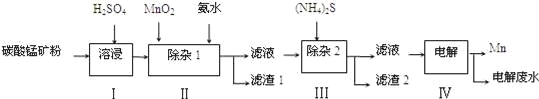
��֪25�����������ʵ��ܶȻ��������£�
���� | Mn��OH��2 | Co��OH��2 | Ni��OH��2 | MnS | CoS | NiS |
Ksp | 2.1��10��13 | 3.0��10��16 | 5.0��10��16 | 1.0��10��11 | 5.0��10��22 | 1.0��10��22 |
��1���������У�MnCO3�����ᷴӦ�Ļ�ѧ����ʽ�� ��
��2������������Ҫ�����Թ��������ᣬ��Ŀ����3�㣺��ʹ�����е����ʳ�ַ�Ӧ�����ṩ����������ʱ����Ҫ�����Ի������� ��
��3���������У�MnO2�����������¿ɽ�Fe2+����ΪFe3+���÷�Ӧ�����ӷ���ʽ�� ��
�Ӱ�ˮ������Һ��pHΪ5.0��6.0���Գ�ȥFe3+��
��4���������У���Ҫ�õ��IJ�����������������©���⣬���� ������2����Ҫ�ɷ��� ��
��5������ķ�ˮ�л�����Mn2+������ʯ�������һ�������õ�Mn��OH��2���������˺�������Һ�м�������Na2S�����ж�����������ʹ��Һ��c��Mn2+����1.0��10��5molL��1����Ӧ������Һ��c��S2������ molL��1��