题目内容
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g) ![]() CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
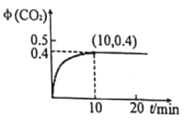
①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:

图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
(5)2SO2(g)+O2(g) ![]() 2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。

【答案】 -227 ac 60% 3.375 > 一定不是 BC a b起始压强大于a,说明其温度高于a,而该反应是放热反应,温度升高,平衡逆向移动,SO3体积分数减小
【解析】 (1)已知:反应I:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746kJ.mol-1;反应II:4CO(g)+2NO2(g)
N2(g)+2CO2(g) △H=-746kJ.mol-1;反应II:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1。根据盖斯定律,由(II-I)
N2(g)+4CO2(g) △H=-1200kJ.mol-1。根据盖斯定律,由(II-I)![]() 可得反应NO2(g)+CO(g)
可得反应NO2(g)+CO(g)![]() CO2(g)+NO(g),所以其△H=[-1200kJ.mol-1 -(-746kJ.mol-1)]
CO2(g)+NO(g),所以其△H=[-1200kJ.mol-1 -(-746kJ.mol-1)]![]() -227kJ/mol。
-227kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,该反应的正反应是气体分子数减少的反应。a.体系压强保持不变,说明各组分的物质的量保持不变;b.由于气体的质量和体积始终不变,所以容器中气体密度保持不变;c.混合气体颜色保持不变,说明各组分的浓度保持不变;d.每消耗2molNO2的同时生成1molN2,不能说明正反应速率和逆反应速率相等。综上所述,能说明反应达到平衡状态的是ac。
(3)①由图中信息可知,达到平衡状态时,CO2体积分数为0.4,n(CO2)=(1mol+0.5mol)![]() 0.4=0.6mol,则SO2的变化量是0.3mol,其转化率为
0.4=0.6mol,则SO2的变化量是0.3mol,其转化率为![]() 60%。各组分CO、SO2、CO2、S的平衡浓度分别为0.04mol/L、0.02 mol/L、0.06 mol/L、0.03 mol/L,该温度下反应的平衡常数K=
60%。各组分CO、SO2、CO2、S的平衡浓度分别为0.04mol/L、0.02 mol/L、0.06 mol/L、0.03 mol/L,该温度下反应的平衡常数K=![]() =3.375。②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时Qc=
=3.375。②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时Qc=![]() <K,所以反应向正反应方向进行,v(正) >v(逆)。
<K,所以反应向正反应方向进行,v(正) >v(逆)。
(4)由于该反应是放热反应,平衡常数随温度升高而减小,所以其平衡转化率随温度升高而减小,温度越低NO的平衡转化率越大。A点对应的温度低、反应速率较慢,NO的转化率小于B点,所以A点尚未达到平衡状态,故A点NO的转化率一定不是该温度下的平衡转化率;催化剂不变则活化能不变,B点之后,NO转化率降低的原因可能是副反应增多或催化剂活性降低,选BC。
(5) a和b平衡时,SO3体积分数较大的是a,判断的依据是:由图可知,b起始压强大于a,由于容器体积相同、起始投料相同,说明其温度高于a ,而该反应是放热反应,温度升高,平衡逆向移动,SO3体积分数减小。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是___________________________。
(2)写出Fe3+水解的离子方程式_____________________________________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉淀的pH | 10.4 | 6.4 |
|
|
沉淀完全的pH | 12.4 | 8.0 |
|
|
开始溶解的pH |
| 10.5 |
|
|
Ksp | 5.6×10-12 |
| 6.8×10-6 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、氨水
(5)“滤液4”之后的操作依次为______________、______________、过滤、洗涤、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于__________用代数式表示。




