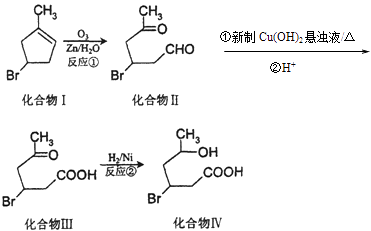
题目内容
【题目】已知β锂辉矿(主要成分为LiAlSi2O6 , 还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.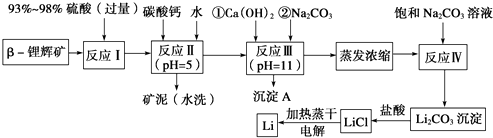
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有 .
(2)反应Ⅰ发生主反应:LiAlSi2O6+H2SO4(浓Li2SO4+++H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是 .
(4)反应Ⅲ中生成沉淀A成分: . (填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式: .
(6)洗涤所得Li2CO3沉淀要使用(选填“热水”或“冷水”),你选择的理由是 .
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2 , 用电极反应式说明原因 .
【答案】
(1)适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌
(2)2;4;1;Al2(SO4)3;4SiO2↓;4
(3)除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀
(4)Mg(OH)2、CaCO3
(5)2Li++CO32﹣=Li2CO3↓
(6)热水;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
(7)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2 , 2O2﹣﹣4e﹣=O2↑
【解析】解:(1)将硅酸盐改为氧化物形式的方法为:依次将各元素写成氧化物形式,中间用“”连接,同时要注意氧化物先后顺序,为Li2OAl2O34SiO2 , 所以答案是:Li2OAl2O34SiO2;(2)LiAlSi2O6 与H2SO4(浓)反应生成硫酸锂、硫酸铝、二氧化硅和水,结合原子守恒配平得到化学方程式为:2LiAlSi2O6+4H2SO4(浓)=Li2SO4+Al2(SO4)3+4SiO2↓+4H2O,
所以答案是:2,4,1,Al2(SO4)3 , 4SiO2↓,4;(3)β﹣锂辉矿在加入过量浓硫酸后,只有SiO2不溶,同时Fe2+被氧化为Fe3+ , 并生成CaSO4沉淀,所以溶液中含有Fe3+、Al3+、Mg2+、Li+等离子,依据实验目的可知必须除去杂质离子,故在反应Ⅱ中加入碳酸钙的作用为:可除去反应Ⅰ中过量的H2SO4 , 降低溶液中c(H+),根据pH=5,可使Fe3+、Al3+完全沉淀,
所以答案是:除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀;(4)利用题干信息知反应Ⅲ要除去Mg2+ , 但在加入沉淀剂Ca(OH)2时会引入大量Ca2+ , 故还需加入Na2CO3除去Ca2+ , 即沉淀A为Mg(OH)2沉淀与CaCO3沉淀的混合物,反应的离子方程式为:Mg2++2OH﹣═Mg(OH)2↓、Ca2++CO32﹣═CaCO3↓,
所以答案是:Mg(OH)2、CaCO3;(5)蒸发浓缩过程中主要发生锂离子结合碳酸根离子生成碳酸锂,反应的离子方程式为:2Li++CO32﹣=Li2CO3↓,
所以答案是:2Li++CO32﹣=Li2CO3↓;(6)实验室里分离固液混合物的操作是过滤,由题中给出Li2CO3的溶解度与温度的关系,可知洗涤Li2CO3沉淀要使用热水,Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗,
所以答案是:热水;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;(7)由有氧气产生可逆推知可能的原因:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2 ,
所以答案是:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2 ;