题目内容
【题目】磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.Ⅰ.白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(约1550℃)下通过下面两个反应共熔得到.
①2Ca3(PO4)2(s)+5C(s)=6CaO(s)+P4(s)+5CO2(g)△H1=+Ql kJmol﹣1
②CaO(s)+SiO2(s)=CaSiO3(s)△H2=﹣Q2 kJmol﹣1
(1)写出电炉中发生总反应的热化学方程式Ⅱ.三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料.氯化水解法生产三氯氧磷的流程如图甲: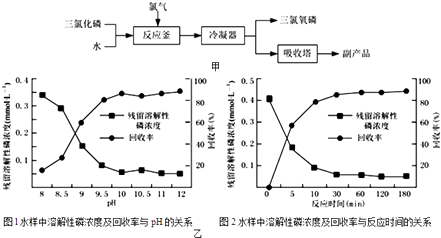
(2)写出氯化水解法生产三氯氧磷的化学方程式为 . 氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水.在废水中先加入适量漂1白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收.
(3)POCl3、H3PO4、H3PO3中磷元素的化合价分别为、、 .
(4)在沉淀前先加入适量漂白粉的作用是 .
(5)Ⅲ.如图乙是不同条件对磷的沉淀回收率的影响图象.处理该厂废水最合适的工艺条件为(选填字母).a.调节pH=9 b.调节pH=10 c.反应时间30min d.反应时间120min
(6)己知磷酸是三元酸,其各级电离常数如下:K1=7.1×10﹣3 K2=6.3×l0﹣8K3=4.2×10﹣13 , 则0.1mol/L的NaH2PO4溶液的pH7(填>,=,<).
【答案】
(1)2Ca3(PO4)2(s)+6SiO2(s)+5C(s) ![]() 6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJ?mol﹣1
6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJ?mol﹣1
(2)PCl3+H2O+Cl2=POCl3+2HCl
(3)+5;+5;+3
(4)将+3价的磷氧化为+5价的磷(将H3PO3氧化为H3PO4)
(5)bc
(6)<
【解析】解:Ⅰ.(1)①2Ca3(PO4)2(s)+5C(s)=6CaO(s)+P4(s)+5CO2(g)△H1=+Ql kJmol﹣1②CaO(s)+SiO2(s)=CaSiO3(s)△H2=﹣Q2 kJmol﹣1依据热化学方程式和盖斯定律计算得到①﹣②×6得到化学方程式为:2Ca3(PO4)2(s)+6SiO2(s)+5C(s) ![]() 6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJmol﹣1 ,
6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJmol﹣1 ,
所以答案是:2Ca3(PO4)2(s)+6SiO2(s)+5C(s) ![]() 6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJmol﹣1;Ⅱ.(2)氯化水解法是用三氯化磷、氯气与水反应生成三氯氧磷和盐酸,其化学方程式为:PCl3+H2O+Cl2=POCl3+2HCl,
6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJmol﹣1;Ⅱ.(2)氯化水解法是用三氯化磷、氯气与水反应生成三氯氧磷和盐酸,其化学方程式为:PCl3+H2O+Cl2=POCl3+2HCl,
所以答案是:PCl3+H2O+Cl2=POCl3+2HCl;(3)氯元素显﹣1价,氢元素显+1价,氧元素显﹣2价,设磷元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:POCl3、H3PO4、H3PO3中磷元素的化合价分别为+5、+5、+3,
所以答案是:+5、+5、+3;(4)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水,在废水中先加入适量漂白粉,使废水中的H3PO3氧化为PO43﹣ , 使其加入生石灰后能完全转化为磷酸的钙盐,达到较高的回收率;
所以答案是:将+3价的磷氧化为+5价的磷(将H3PO3氧化为H3PO4);Ⅲ.(5)根据图1、2可确定pH=10、反应时间30 min时磷的沉淀回收率较高,则处理该厂废水最合适的工艺条件为pH=10、反应时间30 min,
所以答案是:bc;(6)NaH2PO4溶液中存在水解平衡:H2PO4﹣+H2OH3PO4+OH﹣ , 电离平衡:H2PO4﹣HPO42﹣+H+;磷酸是三元酸,其各级电离常数如下:K1=7.1×10﹣3 K2=6.3×l0﹣8 K3=4.2×10﹣13 , K1>K2>K3 , H2PO4﹣在水溶液里电离程度大于水解程度,0.1mol/L的NaH2PO4溶液中按三级电离全部电离2CK3<K2 , 所以NaH2PO4溶液中按二级电离粗略计算,0.1mol/L>6.3×l0﹣8 , 所以溶液的pH=﹣lgc(H+)≈1,实际略小于1,显酸性,即PH<7,
所以答案是:<.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 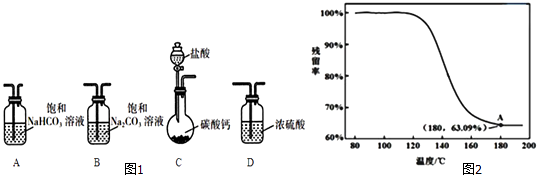
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)