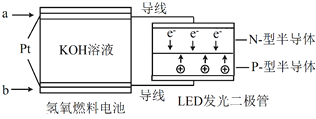
题目内容
【题目】下列说法正确的是( )
A.活化分子碰撞即发生化学反应
B.升高温度会加快反应速率,其主要原因是增加了活化分子碰撞的次数
C.有气体参加的化学反应,若增大压强,可增大活化分子百分数,从而使反应速率增大
D.活化分子间的碰撞不一定是有效碰撞
【答案】D
【解析】解:A.活化分子发生有效碰撞才能发生化学反应,故A错误;B.升高温度,使更多的分子成为活化分子,活化分子百分数增加,反应速率增大,故B错误;
C.增大压强,单位体积活化分子数目增大,但百分数不变,故C错误;
D.活化分子发生化学反应的碰撞为有效碰撞,故D正确.
故选D.

【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 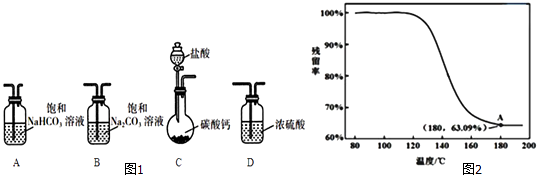
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)
【题目】第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是 . (填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如表:
元素 | Mn | Fe | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn元素价电子排布式为 , 气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 .
(3)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 . 
(4)电镀厂排放的废水中常含有剧毒的CN﹣离子,可在X的催化下,先用NaClO将CN﹣氧化成CNO﹣ , 再在酸性条件下CNO﹣继续被NaClO氧化成N2和CO2 .
①与CNO﹣互为等电子体微粒的化学式为(写出一种即可).
②氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 .