题目内容
11.下列化学用语所表示的微粒中,不能与盐酸发生化学反应的是( )| A. |  | B. | ${\;}_{11}^{23}$Na | C. | 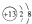 | D. | Mg |
分析 A.原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层,据此进行分析解答;
B.元素符号左上角的数字为质量数,左下角的数字为质子数;
C.根据A分析可知:原子核内质子数=核外电子数,阳离子:核外电子数=核内质子数-所带电荷数,阴离子:核外电子数=核内质子数+所带电荷数,该符号表示铝离子;
D.镁为活泼金属,能和酸反应;
解答 解:A.由提供的原子结构示意图可知,圆圈内的数字是3,表示核内质子数为3;弧线表示电子层,表示该原子原子核外电子层数为2;弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层,1表示最外层电子数为1,为元素Li,金属锂能和盐酸反应生成氯化锂和氢气,故A错误;
B.${\;}_{11}^{23}$Na为钠元素,最外层为电子数为1,为活泼金属,金属钠能和盐酸反应生成氯化钠和氢气,故B错误;
C.阳离子:核外电子数=核内质子数-所带电荷数,图中符号表示铝离子,铝离子不能和盐酸反应,故C正确;
D.镁为活泼金属,金属镁能和盐酸反应生成氯化镁和氢气,故D错误;
故选C.
点评 本题主要考查学生对化学用语的书写和理解能力,解题关键是分清化学用语所表达的对象,注重基础,题目难度较易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2. 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )| A. | $\root{3}{\frac{2M}{p{N}_{A}}}$cm | B. | $\root{3}{\frac{M}{2p{N}_{A}}}$cm | C. | $\root{3}{\frac{2{N}_{A}}{pM}}$cm | D. | $\root{3}{\frac{M}{8p{N}_{A}}}$cm |
6.现有烃的含氧衍生物A,还原A时得醇B,氧化A时得C,由B、C反应可生成高分子化合物,其结构简式为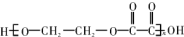 ,以下叙述错误的是( )
,以下叙述错误的是( )
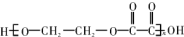 ,以下叙述错误的是( )
,以下叙述错误的是( )| A. | A属于醛类 | |
| B. | A有相对分子质量为58 | |
| C. | A分子中有6个原子含C 40% | |
| D. | 1molA与足量银氨溶液反应还原出4molAg |
16.Mg3N2与水反应的化学方程式为Mg3N2+6H2O═3Mg(OH)2+2NH3↑,下列说法错误的是( )
| A. | 上述反应中,有两种离子化合物 | |
| B. | Mg3N2中,N3-的半径比Mg2+的半径大 | |
| C. | H2O与NH3含有相同的电子数,但H2O比NH3的稳定性差 | |
| D. | 碱性:Mg(OH)2>Al(OH)3 |
3.在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为2mol•L-1、1mol•L-1、2mol•L-1.当反应达到平衡时,容器内各物质的浓度可能为( )
| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |
1.下列对于加成反应的说法中正确的是( )
| A. | 加成反应的结果是使有机化合物中不再含有不饱和键 | |
| B. | 福尔马林可以作为食品保鲜剂 | |
| C. | 甲苯在光照条件下与氯气反应,主要生成2,4-二氯甲苯 | |
| D. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等 |
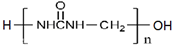 )可用于胶合板、刨花板等人造板材的生产及室内装修,但在使用过程中会释放出有毒物质,请写出合成该物质的单体的结构简式:CO(NH2)2、HCHO.
)可用于胶合板、刨花板等人造板材的生产及室内装修,但在使用过程中会释放出有毒物质,请写出合成该物质的单体的结构简式:CO(NH2)2、HCHO. )具有碱性.(选填“酸性”、“碱性”或“中性”)
)具有碱性.(选填“酸性”、“碱性”或“中性”)
 ,操作②的名称为重结晶.
,操作②的名称为重结晶. 转化为
转化为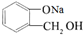 ,所选择的最佳试剂为H2O.
,所选择的最佳试剂为H2O.