题目内容
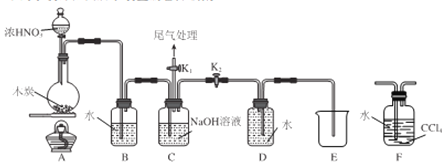
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
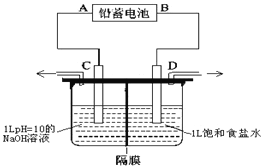
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
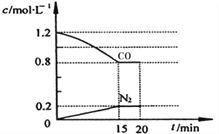
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。
【答案】 C(s)+2CuO(s)==Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1 阴 2Cu-2e-+2OH-=Cu2O+H2O 4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O > < 0.025 mol/L
2Cu2O+N2↑+6H2O > < 0.025 mol/L
【解析】(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
由①+②-③![]() 得C(s)+2CuO(s)==Cu2O(s)+CO(g),ΔH= -169 kJ·mol-1+(-110.5kJ·mol-1)-(-157kJ·mol-1)
得C(s)+2CuO(s)==Cu2O(s)+CO(g),ΔH= -169 kJ·mol-1+(-110.5kJ·mol-1)-(-157kJ·mol-1)![]() =+34.5kJ·mol-1则方法a发生反应的热化学方程式是C(s)+2CuO(s)==Cu2O(s)+CO(g) ΔH=+34.5kJ·mol-1。
=+34.5kJ·mol-1则方法a发生反应的热化学方程式是C(s)+2CuO(s)==Cu2O(s)+CO(g) ΔH=+34.5kJ·mol-1。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,则铜为阳极,阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O,由于阳极需要OH-参与反应,所以该电池中离子交换膜为阴离子交换膜。
(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O。
2Cu2O+N2↑+6H2O。
(4)①水的分解是吸热反应,温度越高,水的转化率越高,压强越大,水的转化率越小。由表中数据可知,T2温度下水蒸气的转化率最大(50%),所以实验的温度T2>T1。
②由表中数据可知,实验①在第20min达到平衡,而实验②在第10min即达到平衡,所以,催化剂催化效率:实验①<实验②。
③在实验③达到平衡状态后,由表中数据可以求出氧气的平衡浓度为0.025mol/L,该反应的平衡常数K=0.025。向该容器中通入水蒸气与氢气各0.1mol之后,Qc=0.025=K,说明已达平衡,则容器中氧气的浓度仍为0.025mol/L。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动_________(填字母)。
a、铝 b、玻璃 c、银 d、铁
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
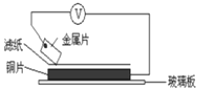
金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:_______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置:
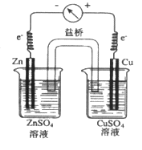
该电池的正极反应是_____________,负极反应 __________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“![]() ”代表反应容器,“
”代表反应容器,“![]() ”代表导线,“
”代表导线,“![]() ”代表电极,“
”代表电极,“![]() ”代表小灯泡,
”代表小灯泡,
在下图方框内画出装置图并指出电极材料和电解质溶液,标出电源的正负极________。