题目内容
【题目】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:
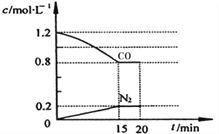
①有害气体NO的转化率为________, 0~15min NO的平均速率v(NO)=______mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________(保留两位有效数字)。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJmol-1 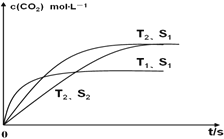 40% 0.027mol/(Lmin) cd 向左 0.14
40% 0.027mol/(Lmin) cd 向左 0.14
【解析】试题分析:(1)根据盖斯定律计算汽车尾气中NO和CO在催化转化器中相互反应生成无污染气体的焓变;(2)催化剂能加快化学反应速率,不能使平衡发生移动,平衡时CO2的浓度与T2、S2相同;(3)①根据转化率=![]() 计算;根据
计算;根据![]() 计算速率;②根据平衡移动原理分析CO浓度减小的原因;③利用“三段式”计算平衡常数,计算再向容器中充入NO、N2各0.4mol时的Q值,根据Q、K的关系判断平衡移动方向;温度相同,平衡常数不变;
计算速率;②根据平衡移动原理分析CO浓度减小的原因;③利用“三段式”计算平衡常数,计算再向容器中充入NO、N2各0.4mol时的Q值,根据Q、K的关系判断平衡移动方向;温度相同,平衡常数不变;
解析:(1)①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
根据盖斯定律,②×2-①得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJmol-1;(2)催化剂能加快化学反应速率,不能使平衡发生移动,平衡时CO2的浓度与T2、S2相同,所以若催化剂的表面积S1>S2, c(CO2)在T2、S2条件下达到平衡过程的变化曲线是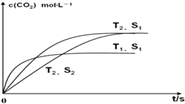 ;
;
(3)根据图像
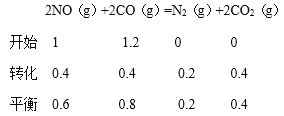
①转化率=![]() =
=![]() ;
; ![]() =
=![]() 0.027mol/(Lmin);②a.缩小容器体积,CO浓度增大,故a错误;b.增加CO的量,CO的浓度一定增大,故b错误; c.降低温度,平衡正向移动,CO浓度减小,故c正确; d.扩大容器体积,CO浓度一定减小,故d正确,选cd;③根据“三段式”,平衡常数
0.027mol/(Lmin);②a.缩小容器体积,CO浓度增大,故a错误;b.增加CO的量,CO的浓度一定增大,故b错误; c.降低温度,平衡正向移动,CO浓度减小,故c正确; d.扩大容器体积,CO浓度一定减小,故d正确,选cd;③根据“三段式”,平衡常数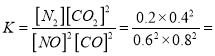 0.14 ,再向容器中充入NO、N2各0.4mol时的Q=
0.14 ,再向容器中充入NO、N2各0.4mol时的Q=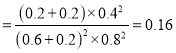 , Q>K,平衡向左移动;温度相同,平衡常数不变,移动后在达到平衡时的平衡常数的值是0.14;
, Q>K,平衡向左移动;温度相同,平衡常数不变,移动后在达到平衡时的平衡常数的值是0.14;

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=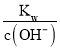 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。


