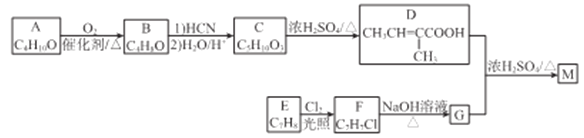
题目内容
【题目】某小组对碳与浓硝酸的反应进行探究,已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O。请回答下列可题:
I.甲同学设计 如图所示装置制备并收集NO
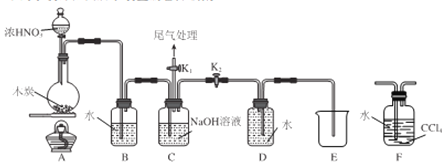
(1)碳与浓硝酸反应的化学方程式为__________________。
(2)C的作用为_______________。
(3)乙同学认为用装置F代替B更合理,理由为_______________。
(4)乙同学用改进后的装置进行实验。
①将浓HNO3滴入圆底烧瓶中的操作为__________________。
②点燃A处酒精灯开始反应后,圆底烧瓶中的现象为________________。
II.探究NO与Na2O2反应
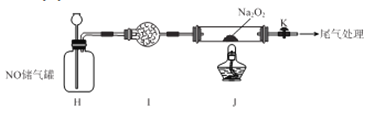
已知NaNO2既有氧化性,又有还原性;J 处硬质玻璃管中制得的NaNO2中含有少量NaNO3。
(5)检验上图装置气密性的方法为____________________。
(6)实验结束后,设计实验证明J 处硬质玻璃管中有NaNO2生成________________。
供选试剂:蒸馏水KI-淀粉溶液,KMnO4溶液、NaOH溶液.BaCl2溶液、稀硫酸
【答案】 C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O 除去反应生成的CO2 装置F可以起到防倒吸的作用 打开分液漏斗玻璃塞(或将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准),旋转活塞,使浓硝酸滴入圆底烧瓶 剧烈反应,木炭逐渐减少,液体中有气泡冒出,烧瓶中出现红棕色气体 关闭K,由长颈漏斗向广口瓶中加水至长颈漏斗中的液面高于广口瓶,一段时间后液面差不变则气密性良好 取少量反应后的固体溶于蒸馏水,滴几滴经稀硫酸酸化的KMnO4溶液,溶液褪色则有NaNO2 生成
4NO2↑+CO2↑+2H2O 除去反应生成的CO2 装置F可以起到防倒吸的作用 打开分液漏斗玻璃塞(或将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准),旋转活塞,使浓硝酸滴入圆底烧瓶 剧烈反应,木炭逐渐减少,液体中有气泡冒出,烧瓶中出现红棕色气体 关闭K,由长颈漏斗向广口瓶中加水至长颈漏斗中的液面高于广口瓶,一段时间后液面差不变则气密性良好 取少量反应后的固体溶于蒸馏水,滴几滴经稀硫酸酸化的KMnO4溶液,溶液褪色则有NaNO2 生成
【解析】I. (1). 碳与浓硝酸反应生成CO2、NO2和H2O,化学方程式为C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O,故答案为:C+4HNO3(浓)
4NO2↑+CO2↑+2H2O,故答案为:C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O;
4NO2↑+CO2↑+2H2O;
(2). 碳与浓硝酸反应生成的CO2、NO2通入B装置的水中,NO2与水反应生成HNO3和NO,再将混合气体通入装置C的NaOH溶液中,可以除去NO中混有的CO2,故答案为:除去反应生成的CO2;
(3). 将碳与浓硝酸反应生成CO2、NO2通入B装置的水中,因NO2与水反应生成HNO3和NO,造成气体减少、压强减小,从而产生倒吸,若将混合气体通入CCl4中,则不会产生倒吸,故答案为:装置F可以起到防倒吸的作用;
(4). ①. 将分液漏斗中的浓HNO3顺利滴入圆底烧瓶,需先平衡压强,则正确的操作步骤为:打开分液漏斗玻璃塞(或将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准),旋转活塞,使浓硝酸滴入圆底烧瓶,并控制滴加速度,故答案为:打开分液漏斗玻璃塞(或将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准),旋转活塞,使浓硝酸滴入圆底烧瓶;
②. 向圆底烧瓶中加入浓硝酸后,点燃A处酒精灯,碳与浓硝酸剧烈反应,木炭逐渐减少,液体中有气泡冒出,烧瓶中出现红棕色气体,故答案为:剧烈反应,木炭逐渐减少,液体中有气泡冒出,烧瓶中出现红棕色气体;
II. (5). 检验装置的气密性需先形成密闭体系,正确的方法是:关闭装置后端开关K,由长颈漏斗向广口瓶中加水至长颈漏斗中的液面高于广口瓶,一段时间后液面的高度差不变,则气密性良好,故答案为:关闭K,由长颈漏斗向广口瓶中加水至长颈漏斗中的液面高于广口瓶,一段时间后液面差不变则气密性良好;
(6). J处硬质玻璃管中制得的NaNO2中含有少量NaNO3,因NaNO3在酸性条件下也具有强氧化性,所以不能使用还原性的试剂如KI-淀粉溶液检验,可根据NaNO2具有还原性而NaNO3没有还原性,取少量反应后的固体溶于蒸馏水,滴几滴经稀硫酸酸化的KMnO4溶液,若溶液褪色则有NaNO2生成,故答案为:取少量反应后的固体溶于蒸馏水,滴几滴经稀硫酸酸化的KMnO4溶液,溶液褪色则有NaNO2生成。

【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。