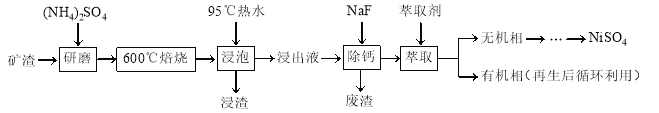
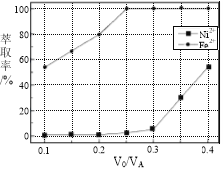
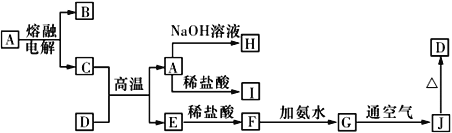
题目内容
【题目】100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )
A. 加入适量的6mol/L的硫酸 B. 适当加热
C. 加入适量蒸馏水 D. 加入适量的稀硝酸
【答案】B
【解析】
A、加入适量6mol/L的硫酸,增大氢离子的浓度,也增大了氢离子的物质的量,A错误;
B、加热会加快反应速率,且没有改变氢离子的物质的量,不影响生成的氢气的总量,B正确;
C、加入适量蒸馏水,氢离子浓度降低,减小反应速率,C错误;
D、加入适量的硝酸溶液,金属锌和硝酸反应不会产生氢气,D错误;
答案选B。

【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。