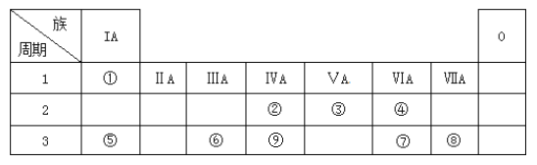
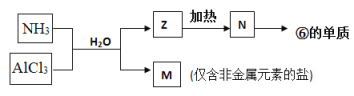
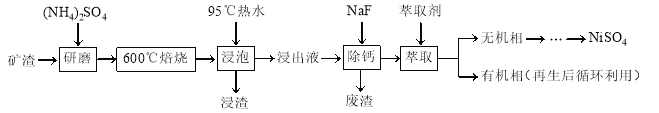
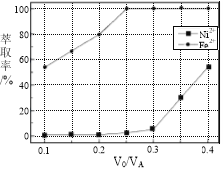
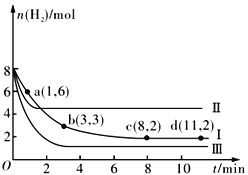
题目内容
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:
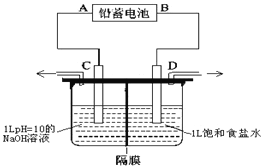
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的_________极(填“正”或“负”),电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
【答案】负Pb+2e-+SO42-=PbSO42Cl-+2H2O![]() 2OH-+H2↑+Cl2↑2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑DC0.2
2OH-+H2↑+Cl2↑2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑DC0.2
【解析】
电解一段时间后,若在电解池中C极一侧出来的气体无色无味是氢气,则C极是阴极,D极一侧出来的气体呈黄绿色有刺激性气味是氯气,D极是阳极,所以原电池中A极是负极,B极是正极,据此解答。
根据以上分析可知A极是负极,B极是正极,C极是阴极,D极是阳极,则
(1)A是负极,负极上铅失电子和硫酸根离子结合生成硫酸铅,则负极电极反应为Pb+2e-+SO42-=PbSO4;
(2)电解氯化钠溶液时,C是阴极,阴极上得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)根据以上分析可知电极C的电极反应为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
(4)氯碱工业中所用的高分子隔膜叫做阳离子膜,其作用是让阳离子钠离子穿过,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,同时防止氯气和氢氧化钠接触发生反应。电解池中阳离子向阴极移动,因此电解时Na+从D极区移向C极区;
(5)根据方程式Pb+PbO2+4H++2SO42-=2PbSO4+2H2O可知当转移2mol电子时,消耗硫酸的物质的量是2mol,则转移0.2mol电子时消耗硫酸的物质的量是0.2mol。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。