题目内容
2.现有11.6g有机物甲完全燃烧,产生0.6mol CO2和0.6mol H2O,相同条件下,甲蒸汽对氧气的相对密度为1.8125,则甲的摩尔质量为58g/mol,分子式为C3H6O.分析 根据甲蒸汽对氧气的相对密度计算有机物的相对分子质量,进而计算11.6g有机物的物质的量,结合上火车二氧化碳和水的物质的量关系计算.
解答 解:相同条件下,甲蒸汽对氧气的相对密度为1.8125,则甲的相对分子质量为32×1.8125=58,
11.6g有机物的物质的量为$\frac{11.6g}{58g/mol}$=0.2mol,
产生0.6mol CO2和0.6mol H2O,
可知1mol有机物含有3molC、6molH原子,
因3×12+6=42<58,
则含有O元素,1mol有机物含有的O原子的物质的量为$\frac{58-42}{16}$mol=1mol,
所以有机物的分子式为C3H6O,
故答案为:58g/mol;C3H6O.
点评 本题考查了常见有机物分子式的确定计算方法,题目难度中等,注意掌握确定有机物分子式的计算方法,明确相对密度与相对分子量的关系是解题关键.

练习册系列答案
相关题目
12.以下进行性质比较的实验设计,不合理的是( )
| A. | 比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol•L-1NaOH溶液中 | |
| B. | 比较氯、溴非金属性:氯气通入溴化钠溶液中 | |
| C. | 比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 | |
| D. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
13.据相关资料,把铝粉与下列氮的气态氧化物混合后,加热至高温,均可生成氮气和氧化铝.若反应后气体的压强是反应前气体压强的$\frac{1}{2}$(恒温恒压条件下测得),则氮的氧化物是( )
| A. | NO | B. | N2O3 | C. | N2O | D. | N2O5 |
7.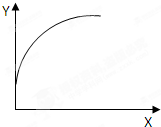 在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
 在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )| X | Y | |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 再加入C | A的质量分数 |
| C | 再加入A | B的转化率 |
| D | 压强 | B的浓度 |
| A. | A | B. | B | C. | C | D. | D |
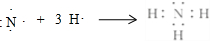
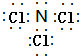
 .
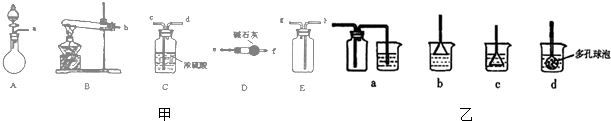
.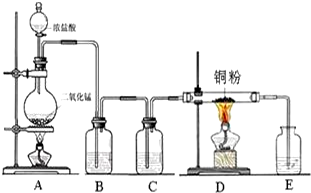 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: