题目内容
14.称取含MnO-Cr2O3的矿石2.0000g,以Na2O2熔融后,经过浸取、煮沸,除去过氧化合物后得到含MnO42-和CrO42-的溶液.酸化溶液,过滤除去MnO2,滤液及洗涤液以50.00mL0.1000mol•L-1FeSO4溶液处理.过量的FeSO4用0.01000mol•L-1KMnO4溶液滴定,终点时消耗18.40mL.MnO2沉淀用10.00mL0.1000mol•L-1FeSO4酸性溶液处理,过量的FeSO4以0.01000mol•L-1KMnO4溶液滴定,终点时消耗8.24mL.写出酸化溶液和滴定过程所涉及的所有化学反应方程式,并计算矿石中MnO和Cr2O3的质量百分数.[Mr(MnO)=70.94;Mr(Cr2O3)=151.9].
分析 以Na2O2熔融后,经过浸取、煮沸,除去过氧化合物后得到含MnO42-和CrO42-的溶液.酸化发生3MnO42-+4H+=MnO2+2MnO4-+2H2O、2CrO42-+2H+=Cr2O72-+H2O,滴定时发生MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O、4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O、6H++Cr2O72-+6Fe2+=2Cr3++6Fe3++2H2O,结合3MnO~3MnO42-~2MnO4-~5Fe2+、Cr2O3~Cr2O72-~6Fe2+计算.
解答 解:以Na2O2熔融后,经过浸取、煮沸,除去过氧化合物后得到含MnO42-和CrO42-的溶液.酸化发生3MnO42-+4H+=MnO2+2MnO4-+2H2O、2CrO42-+2H+=Cr2O72-+H2O,滴定时发生MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O、4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O、6H++Cr2O72-+6Fe2+=2Cr3++6Fe3++2H2O,
由3MnO~3MnO42-~2MnO4-~10Fe2+可知,n(MnO)=$\frac{3}{2}$n(MnO4-)、n(Fe2+)=5(MnO4-),
则w(MnO)=$\frac{\frac{3}{2}[n(F{e}^{2+})-5n(KMn{O}_{4})]×M(MnO)}{矿石质量}$=$\frac{\frac{3}{2}[0.1mol/L×0.01L-5×0.01mol/L×0.0824L]×70.93g/mol}{2.0000g}$×100%=3.13%,
由Cr2O3~Cr2O72-~6Fe2+可知,n(Cr2O3)=$\frac{1}{6}$n(Fe2+),w(Cr2O3)=$\frac{\frac{1}{6}\{[n(F{e}^{2+})-5n(KMn{O}_{4})]-\frac{2}{3}n(MnO)×5\}}{矿石质量}$×M(Cr2O3)×100%=$\frac{\frac{1}{6}\{[0.1×0.05-5×0.01×0.184]-(0.1×0.01-5×0.01×0.00824)×5\}×151.99}{2.00}$×100%=1.44%,
答:酸化的反应为3MnO42-+4H+=MnO2+2MnO4-+2H2O、2CrO42-+2H+=Cr2O72-+H2O,滴定涉及的反应为MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O、4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O、6H++Cr2O72-+6Fe2+=2Cr3++6Fe3++2H2O,矿石中MnO和Cr2O3的质量百分数分别为3.13%、1.44%.
点评 本题考查氧化还原反应滴定的计算,把握发生的反应及反应中的物质的量关系为解答的关键,侧重分析与计算能力的综合考查,题目难度较大,为2004年博士研究生入学考试题.

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案 氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时化学能转化为电能 | |
| B. | 该电池的总反应为:2H2+O2═2H2O | |
| C. | 该电池中电极b是正极 | |
| D. | 外电路中电子由电极b通过导线流向电极a |
| A. | 焚烧树叶,以减少垃圾运输量 | |
| B. | 将废弃塑料就地烧掉,以消除“白色污染” | |
| C. | 加高工厂烟囱,以减少二氧化硫对环境的污染 | |
| D. | 运输沙土的车辆盖上苫布,以免增加空气中的粉尘含量 |
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Fe3+、K+、Cl?、SO42? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? |
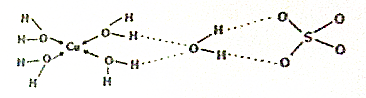
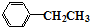 $\stackrel{KMnO_{4}溶液}{→}$
$\stackrel{KMnO_{4}溶液}{→}$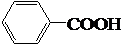
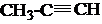 +Br2→CH3-CBr=CHBr
+Br2→CH3-CBr=CHBr $→_{Cl_{2}}^{光照}$
$→_{Cl_{2}}^{光照}$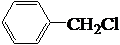 (一卤代物)
(一卤代物)