题目内容
12.以下进行性质比较的实验设计,不合理的是( )| A. | 比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol•L-1NaOH溶液中 | |
| B. | 比较氯、溴非金属性:氯气通入溴化钠溶液中 | |
| C. | 比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 | |
| D. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
分析 A.Mg与NaOH不反应,Al与NaOH反应为Al的特性;
B.氯气通入溴化钠溶液,可置换出溴;
C.Cu加入FeCl3溶液中,反应生成氯化铜、氯化亚铁;
D.高锰酸钾中加入浓盐酸,反应生成氯气.
解答 解:A.Mg与NaOH不反应,Al与NaOH反应为Al的特性,不能比较金属的活泼性,金属性为Mg>Al,由该实验不能完成,故A错误;
B.氯气通入溴化钠溶液,可置换出溴,则非金属性Cl的强,故B正确;
C.Cu加入FeCl3溶液中,反应生成氯化铜、氯化亚铁,Cu作还原剂,则还原性Cu>Fe2+,故C正确;
D.高锰酸钾中加入浓盐酸,反应生成氯气,Mn元素的化合价降低,Cl元素的化合价升高,则氧化性为高锰酸钾>氯气,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质及氧化还原反应等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
2.如图,a和b均为金属棒,当电流计中指针发生偏转,下列说法正确的是( )
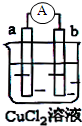

| A. | 电极a表面一定呈红色 | |
| B. | 电极b作负极 | |
| C. | 电极a或b其中有一极一定是金属铁 | |
| D. | 该装置能量转化形式为化学能转化为电能 |
3.下列有关生活中常见的有机物的说法正确的是( )
| A. | 汽油、苯、乙醇都属于烃类物质 | |
| B. | 含5个碳原子的有机物,每个分子中最多可形成5个碳碳单键 | |
| C. | 乙醇能被氧化成乙酸,两者都能与金属钠反应 | |
| D. | 煤的干馏可得煤油;甲烷、乙烯和苯能通过石油分馏得到 |
20.下列说法正确的是( )
| A. | 亚硫酸溶液中含有亚硫酸、水、二氧化硫三种分子 | |
| B. | 用浓盐酸酸化高锰酸钾溶液,可增强高锰酸钾的氧化能力 | |
| C. | 铵盐受热都易分解,生成氨和相应的酸 | |
| D. | SiO2是酸性氧化物,能与氢氧化钠溶液反应,不与任何酸反应 |
7.在烷烃分子中的基团:-CH3,-CH2-, ,
,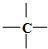 中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )
中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )
 ,
, 中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )
中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )| A. | n0=3n1+2n2+n3 | B. | n0=2(n1+n2+n3+n4)+2 | ||
| C. | n1=n3+2n4+2 | D. | n1=n3+2n2+2 |
1.下列说法正确的是( )
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 反应是吸热还是放热必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小 |