题目内容
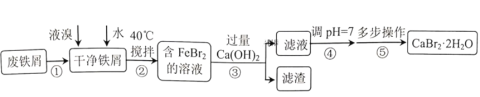
【题目】锡渣主要成分是SnO,还含有少量Fe、Cu、Sb、Pb、As等元素的氧化物.可用下列流程中的方法生产锡酸钠.
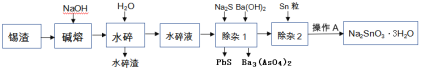
已知: ①砷酸钡难溶于水,Ksp(Ba3(AsO4)2)=10-24
②水碎液中溶质的主要成分为Na2SnO3,Na3AsO4, Na3SbO4,Na2PbO2
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,则SnO参加反应的化学方程式为____________
(2)除杂1的目的是“除砷和铅”,加入硫化钠所发生反应的离子方程式为____________;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),需等体积加入至少____________mol/L的Ba(OH)2.
(3)除杂2中加入Sn粒的目的是____________
(4)已知Na2SnO3·3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,所以最后一步从滤液中得到锡酸钠晶体的操作步骤为____________、过滤、用____________洗涤、____________.
(5)水碎渣中的铁元素主要以氧化物形式存在,回收比较容易,而铜冶炼过程中的铜渣中也有铁元素,但主要以硅酸铁的形式存在,回收方法更复杂:需先加CaO作置换剂,发生钙铁置换反应CaO+FeO·SiO2![]() CaO·SiO2+FeO,在反应过程中,加CaO的同时还需加入还原剂烟煤,则加入还原剂烟煤的作用是____________
CaO·SiO2+FeO,在反应过程中,加CaO的同时还需加入还原剂烟煤,则加入还原剂烟煤的作用是____________
【答案】2SnO+4NaOH+O2=2Na2SnO3+2H2O PbO22-+S2-+2H2O=PbS↓+4OH- 0.0017 除去SbO42-或除锑 在140℃以下加热蒸发或蒸发浓缩、冷却结晶 乙醇 低温干燥 还原FeO以减少生成物,使钙铁置换反应向正反应方向移动
【解析】
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,在转化过程中,Sn由+2价升高到+4价,应有氧化剂参与反应,NaOH不可能作氧化剂,则必有空气中的O2参与反应,由此可写出SnO参加反应的化学方程式。
(2)除杂1的目的是“除砷和铅”,加入的Na2S与Na2PbO2反应,生成PbS,由此可写出发生反应的离子方程式;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),加入Ba(OH)2起两个作用,一个是使AsO43-完全沉淀,另一个是溶解在溶液中,使c(Ba2+)、c(AsO43-)满足Ksp(Ba3(AsO4)2)=10-24。
(3)除杂2中加入Sn粒的目的是使Na3SbO4转化为沉淀,从溶液中去除。
(4)已知Na2SnO3·3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,所以最后一步从滤液中得到锡酸钠晶体的操作步骤为在140℃以下加热蒸发或蒸发浓缩、冷却结晶、过滤、为减少水洗时的溶解损失,应使用乙醇洗涤、最后再低温干燥。
(5)在反应过程中,加CaO的同时还需加入还原剂烟煤,只能还原FeO,则加入还原剂烟煤的作用是还原FeO,减少生成物,有利于平衡的正向移动。
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,在转化过程中,Sn由+2价升高到+4价,应有氧化剂参与反应,NaOH不可能作氧化剂,则必有空气中的O2参与反应,由此可写出SnO参加反应的化学方程式为2SnO+4NaOH+O2=2Na2SnO3+2H2O。答案为:2SnO+4NaOH+O2=2Na2SnO3+2H2O;
(2)除杂1的目的是“除砷和铅”,加入的Na2S与Na2PbO2反应,生成PbS,由此可写出发生反应的离子方程式PbO22-+S2-+2H2O=PbS↓+4OH-;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),加入Ba(OH)2起两个作用,一个是使AsO43-完全沉淀,由离子方程式3Ba2++2AsO43-= Ba3(AsO4)2↓,可求出参加反应的c(Ba2+)1=![]() =0.0015mol/L;另一个是溶解在溶液中,Ba3(AsO4)2需达到沉淀溶解平衡,使c(Ba2+)2=
=0.0015mol/L;另一个是溶解在溶液中,Ba3(AsO4)2需达到沉淀溶解平衡,使c(Ba2+)2=![]() =10-4mol/L,此为混合溶液中的c(Ba2+),换算为原溶液中的浓度,则为2×10-4mol/L;从而得出c(Ba2+)= c(Ba2+)1+c(Ba2+)2(换)=0.0015mol/L+2×10-4mol/L=0.0017mol/L。答案为:PbO22-+S2-+2H2O=PbS↓+4OH-;0.0017;
=10-4mol/L,此为混合溶液中的c(Ba2+),换算为原溶液中的浓度,则为2×10-4mol/L;从而得出c(Ba2+)= c(Ba2+)1+c(Ba2+)2(换)=0.0015mol/L+2×10-4mol/L=0.0017mol/L。答案为:PbO22-+S2-+2H2O=PbS↓+4OH-;0.0017;
(3)除杂2中加入Sn粒的目的是使Na3SbO4转化为沉淀,从溶液中去除。答案为:除去SbO42-或除锑;
(4)最后一步从滤液中得到锡酸钠晶体的操作步骤为在140℃以下加热蒸发或蒸发浓缩、冷却结晶、过滤、为减少水洗时的溶解损失,应使用乙醇洗涤、最后再低温干燥。答案为:在140℃以下加热蒸发或蒸发浓缩、冷却结晶;乙醇;低温干燥;
(5)在反应过程中,加CaO的同时还需加入还原剂烟煤,只能还原FeO,则加入还原剂烟煤的作用是还原FeO,减少生成物,有利于平衡的正向移动。答案为:还原FeO以减少生成物,使钙铁置换反应向正反应方向移动。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
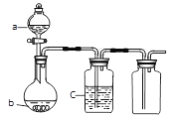
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D