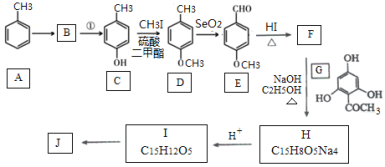
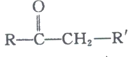题目内容
【题目】在以下各种情形下,下列电离方程式的书写正确的是( )
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.水溶液中CH3COONH4的电离:CH3COONH4![]() CH3COO-+NH4+
CH3COO-+NH4+
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
【答案】C
【解析】
A.熔融状态下硫酸氢钠电离生成钠离子和硫酸氢根离子,电离方程式为NaHSO4═Na++HSO4-,故A错误;
B.醋酸铵属于强电解质,在溶液中完全电离,其电离方程式为:CH3COONH4=CH3COO-+NH4+,故B错误;
C.氢氧化铁是弱电解质,部分电离,电离方程式为Fe(OH)3Fe3++3OH-,故C正确;
D.碳酸是二元弱酸,分步电离,以第一步电离为主,电离方程式为H2CO3H++HCO3-,故D错误;
故选C。

练习册系列答案
相关题目
【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
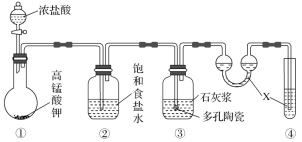
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D