题目内容
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
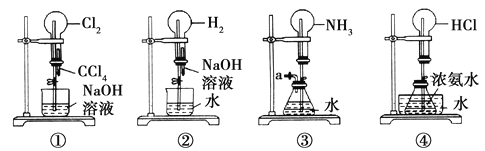
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
【答案】B
【解析】
A.Cl2易溶于有机溶剂CCl4中,烧瓶中的气体压强就会减小,故能形成喷泉,A错误;
B.H2不易溶于水,也不会和NaOH反应,所以烧瓶中的气体压强不会有明显的变化,故不能形成喷泉,B正确;
C.用鼓气装置从装置③的a处不断鼓入空气,导致锥形瓶中液体被压入烧瓶中,氨气极易溶于水,烧瓶中的气体压强就会减小,故能形成喷泉,C错误;
D.浓氨水和氯化氢气体反应,烧瓶中的气体压强就会减小,故能形成喷泉,D错误;
故答案选B。
【点晴】
化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力,所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目