题目内容
2.金属镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)基态镍原子的价电子(外围电子)排布式为3d84s2.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式N2、CN-.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.
如①CH2═CH2、②HC≡CH、③
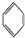 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO>FeO(填“<”或“>”).
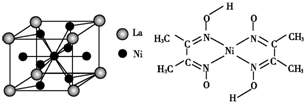
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为LaNi5或Ni5La.
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.
分析 (1)Ni元素原子序数是28,其3d、4s电子为其价电子,3d、4s能级上电子数分别是8、2,据此书写其价电子排布式;
(2)等电子体原子个数相等、价电子数相等;
(3)分子中价层电子对个数是3的原子采用sp2杂化,HCHO分子中C原子价层电子对个数是3且不含孤电子对,为平面三角形结构;
(4)离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比、与离子所带电荷成正比;
(5)利用均摊法确定该物质的化学式;
(6)含有空轨道的原子和含有孤电子对的原子之间易形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间.
解答 解:(1)Ni元素原子序数是28,其3d、4s电子为其价电子,3d、4s能级上电子数分别是8、2,其价电子排布式为3d84s2,故答案为:3d84s2;
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③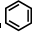 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(4)影响离子晶体熔点的因素是晶格能,晶格能与离子半径成反比、与电荷水成正比,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(5)该晶胞中含La原子个数=8×$\frac{1}{8}$=1,含有Ni=1+8×$\frac{1}{2}$=5,所以其化学式为LaNi5或Ni5La,故答案为:LaNi5或Ni5La;
(6)中心原子提供空轨道配体提供孤电子对形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间,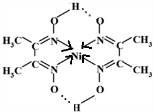 ,故答案为:
,故答案为:
点评 本题考查较综合,涉及晶胞计算、配位键、氢键、原子核外电子排布、原子杂化方式判断、晶格能等知识点,这些都是高考高频点,知道价层电子对互斥理论、构造原理等知识点即可解答,注意配位键和氢键的表示方法,为易错点.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案| A. | NO3- | B. | -NO2 | C. | -OH | D. | 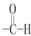 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
| A. | 不同的原子之间只能构成共价化合物 | |
| B. | 单质中不一定存在非极性键 | |
| C. | 非金属原子之间只能构成共价化合物 | |
| D. | Cl2的沸点比F2高,这与化学建的大小有关 |
| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
| A. | Ba(OH)2 | B. | H2O2 | C. | Na2O2 | D. | CaCl2 |
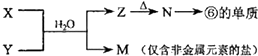 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中最不活泼元素,其原子结构示意图为
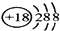
(3)表中最高价氧化物对应的水化物碱性最强的物质是NaOH,酸性最强的物质是HClO4.
(4)④、⑤、⑥元素的离子半径由大到小的顺序是F->Na+>Al3+,④、⑧、⑨简单阴离子的还原性由大到小的顺序是S2->Cl->F-.
(5)由表中元素形成的物质X、Y、Z、M、N可发生以图反应:X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| A. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ•mol-1 | |||||||||||
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol
| |||||||||||
| C. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6 kJ/mol | |||||||||||
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
 .
.