题目内容
18.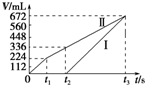 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)(1)原混合溶液中NaCl和CuSO4的物质的量浓度.
(2)电解至t3时,消耗水的质量.
分析 电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,以此来计算.
解答 解:电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,
(1)由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
由t2时生成氧气为112mL,n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,所以c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
答:原混合溶液NaCl和CuSO4的物质的量浓度均为0.1mol/L;
(2)电解至t3时,电解生成氧气为672-224mL=448mL,均来源于水,由2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,n(H2O)=$\frac{0.448L}{22.4L/mol}$×2=0.04mol,所以电解水的质量为0.04mol×18g/mol=0.72g,答:电解至t3时,消耗水的质量为0.72g.
点评 本题考查电解原理,明确发生的电极反应及图图象的对应关系是解答本题的关键,注意(2)中计算电解水的质量可利用生成氧气的体积直接计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 共价键只有方向性 | |
| B. | 离子晶体中只存在阴阳离子间的静电吸引力 | |
| C. | Na2O2中阴阳离子个数比为1:2 | |
| D. | 化学式CO2、SiO2、NaCl、CaH2都可以表示分子 |
| A. | 20Ar | B. | 16O | C. | 18O | D. | 18O2- |
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z的最高价氧化物对应的水化物是酸 |

 某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题: 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源.
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源. 2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
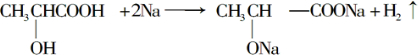 ;
; ;
;