题目内容
10.将11.2L(标准状况)乙烯和某烷烃的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了8.4g;若将该混合气体完全燃烧后所得气体通入浓硫酸,浓硫酸增重25.2g.求(1)原气体混合物中乙烯与烷烃的物质的量之比.
(2)通过计算写出该烷烃的结构简式.
分析 (1)乙烯含有双键,能与溴水发生加成反应,烷烃不能与溴水反应,则溴的四氯化碳溶液增重的质量为乙烯的质量,根据n=$\frac{m}{M}$计算出乙烯的物质的量,再根据n=$\frac{V}{{V}_{m}}$计算出混合气体总物质的量,从而得出该烷烃的物质的量,然后计算出混合气体中乙烯和烷烃的物质的量之比;
(2)浓硫酸增重的为水的质量,根据n=$\frac{m}{M}$计算出水的物质的量,设该烷烃的分子式为CnH2n+2,再根据氢原子守恒计算出n,最后确定该烷烃的结构简式.
解答 解:(1)标况下11.2L混合气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
溴的四氯化碳溶液的质量增加8.4g,由于烷烃不与溴反应,则增重的质量为乙烯的质量,则混合气体中乙烯的物质的量为:$\frac{8.4g}{28g/mol}$=0.3mol,
故混合气体中烷烃的物质的量为:0.5mol-0.3mol=0.2mol,
原气体混合物中乙烯与烷烃的物质的量之比为:0.3mol:0.2mol=3:2,
答:原气体混合物中乙烯与烷烃的物质的量之比为3:2;
(2)浓硫酸增重的质量为水的质量,水的物质的量为:$\frac{25.2g}{18g/mol}$=1.4mol,根据质量守恒,原混合气体中含有H的物质的量为:1.4mol×2=2.8mol,设该烷烃的分子式为CnH2n+2,则:0.3mol×4+(2n+2)×0.2mol=2.8mol,解得:n=3,
则该烷烃的分子式为:C3H8,为丙烷,其结构简式为CH3CH2CH3,
答:该烷烃的结构简式为CH3CH2CH3.
点评 本题考查了混合物的计算,侧重考查有机物分子式、结构简式的确定,题目难度中等,明确质量守恒定律在化学计算中的应用为解答关键,注意掌握常见有机物结构与性质.

| A. | NaOH | B. | Na2O2 | C. | P4 | D. | H2O2 |
| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
| A. | 化学键 | B. | 颜色 | C. | 状态 | D. | 原子种类 |
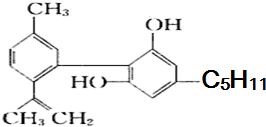 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为: ,它与足量的溴水反应最多消耗Br23mol.
,它与足量的溴水反应最多消耗Br23mol.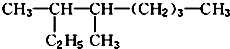 的名称是3,4-二甲基辛烷
的名称是3,4-二甲基辛烷 .
.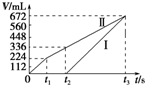 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)