题目内容
8.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法正确的是( )| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z的最高价氧化物对应的水化物是酸 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,Z与X原子的最外层电子数相同,则X与Z同主族,Y与W同主族,则Y与W分别位于第二、第三周期,X的原子半径小于Y,X不可能处于第二周期,故X为H元素,Z为Na元素,X、Y、Z、W的原子最外层电子数之和为14,故Y、W的最外层电子数为$\frac{14-1-1}{2}$=6,故Y为O元素,W为S元素,结合元素周期律与物质性质解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,Z与X原子的最外层电子数相同,则X与Z同主族,Y与W同主族,则Y与W分别位于第二、第三周期,X的原子半径小于Y,X不可能处于第二周期,故X为H元素,Z为Na元素,X、Y、Z、W的原子最外层电子数之和为14,故Y、W的最外层电子数为$\frac{14-1-1}{2}$=6,故Y为O元素,W为S元素,
A、X为H元素,Y为O元素,二者可以形成水和过氧化氢,故A错误;
B、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,即r(Y)<r(W)<r(Z),故B正确;
C、同主族从上到下氢化物的稳定性减弱,则W的简单气态氢化物的热稳定性比Y的弱,故C错误;
D、Z的最高价氧化物对应的水化物是NaOH,是碱,故D错误;
故选B.
点评 本题考查位置结构性质关系、元素化合物知识,难度中等,利用提供数据及位置关系推断元素是解题的关键,根据原子序数及Y与W同族确定二者在周期表中位置,再结合X的原子半径小于Y,推断X是H元素是推断的关键.

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
19.物质间发生化学反应时,一定发生变化的是( )
| A. | 化学键 | B. | 颜色 | C. | 状态 | D. | 原子种类 |
16.下列说法中正确的是( )
| A. | H2O2的电子式: | |
| B. | ${\;}_{17}^{35}$Cl- 与${\;}_{17}^{37}$Cl属同位素 | |
| C. | 单质气体分子中不一定都具有共价键 | |
| D. | CaCl2晶体中既含有离子键又含有共价键 |
3.下列各组微粒中,都互为等子体的是( )
| A. | CO、NO、NaH、N2 | |
| B. | SO2、N${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
7.如图表示单质a与单质b在一定条件下反应生成c,其中c可能是( )

| A. | CuS | B. | FeS | C. | NO2 | D. | FeCl2 |
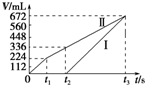 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤) 欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.
欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.