题目内容
11.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )| A. | 50mL 1 mol•L-1NaCl溶液 | B. | 100mL 2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL 1 mol•L-1 NH4Cl溶液 | D. | 150mL 2 mol•L-1 KCl溶液 |
分析 根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关,如50mL 1mol•L-1 MgCl2溶液中氯离子浓度为:c(Cl-)=1mol/L×2=2mol/L,以此解答.
解答 解:50mL 1mol•L-1 MgCl2溶液中氯离子浓度为:c(Cl-)=1mol/L×2=2mol/L,
A.50mL 1 mol•L-1NaCl溶液Cl-的物质的量浓度为1mol/L×1=1mol/L,故A错误;
B.100mL 2 mol•L-1 AlCl3溶液Cl-的物质的量浓度为2mol/L×3=6mol/L,故B错误;
C.100mL 1 mol•L-1 NH4Cl溶液Cl-的物质的量浓度为1mol/L×1=1mol/L,故C错误;
D.150mL 2 mol•L-1 KCl溶液Cl-的物质的量浓度为2mol/L×1=2mol/L,故D正确.
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及计算方法,明确物质的量浓度与溶液体积大小无关.

练习册系列答案
相关题目
1.下列物质属于非电解质的是( )
| A. | H2SO4 | B. | Cl2 | C. | CaCO3 | D. | CO2 |
19.不能用离子方程式:SO42-+Ba2+═BaSO4↓来表示的该反应的化学方程式是( )
| A. | 硝酸钡溶液与稀硫酸 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 碳酸钡与稀硫酸 | D. | 氯化钡溶液与硫酸钠溶液 |
6.能用来区别NH4Cl、NaCl、Na2CO3三种物质的试剂(必要时可以加热)是( )
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | Ba(OH)2溶液 |
16.在粗盐提纯实验中,要溶解10g粗盐,所需要量取水的体积最佳为(常温下氯化钠的溶解度为36g/100g水)( )
| A. | 100mL | B. | 40mL | C. | 50mL | D. | 30mL |
20.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处,且冷却水从冷凝管的上口通入下口流出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
1.保证食品安全,保持营养均衡,是人体健康的基础.下列说法正确的是( )
| A. | 缺乏维生素C易发夜盲症 | |
| B. | 糖尿病患者吃糖量必须限制,但淀粉类事物不必进行限制 | |
| C. | 亚硝酸钠是一种常用的发色剂,但在食品加工或餐饮业中一定要严加控制使用量 | |
| D. | 餐饮业产生的“地沟油”的主要成分是油脂,一定条件下,油脂水解可以生成高级脂肪酸和甘油 |
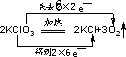 .
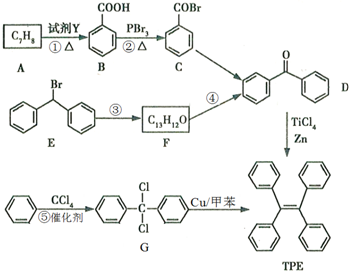
.
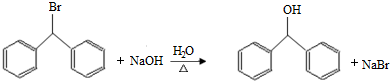 .
. )的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).
)的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).