题目内容
2.用双线桥标出电子转移的方向和数目2KClO3═2KCl+3O2↑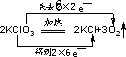 .
.
分析 反应2KClO3═2KCl+3O2↑中Cl元素的化合价由+5价降低为-1价,O元素的化合价由-2价升高为0,以此解答该题.
解答 解:Cl元素的化合价由+5价降低为-1价,O元素的化合价由-2价升高为0,电子转移方向与数目为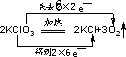 ,
,
故答案为: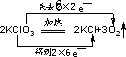 .
.
点评 本题考查氧化还原反应,注意电子、电荷守恒为解答的关键,注意双线桥表示电子转移方向与数目,明确发生的化学反应为解答的关键,题目难度不大.

练习册系列答案
相关题目
12.32g SO2 所含的硫原子的物质的量为( )
| A. | 0.2 mol | B. | 0.3 mol | C. | 0.4 mol | D. | 0.5 mol |
13.下列有关叙述正确的是( )
| A. | 碱性锌锰电池中,MnO2是催化剂 | |
| B. | 铜锌原电池工作时.Zn被氧化为Zn2+ | |
| C. | 放电时.铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 氢氧燃料电他中.通氢气的一极为正极 |
10.根据反应式:2Fe3++2I-═2Fe2++I2,Br2+2Fe2+═2Br-+2Fe3+,可以判断微粒的氧化性从强到弱的顺序是( )
| A. | Fe3+、Br2、I2 | B. | I2、Br2、Fe3+ | C. | Br2、Fe3+、I2 | D. | Br2、I2、Fe3+ |
11.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 50mL 1 mol•L-1NaCl溶液 | B. | 100mL 2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL 1 mol•L-1 NH4Cl溶液 | D. | 150mL 2 mol•L-1 KCl溶液 |
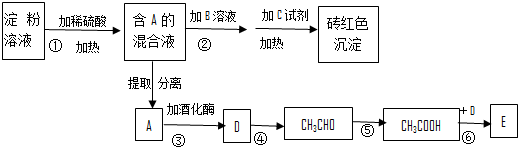
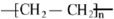 ,反应类型为加聚反应.
,反应类型为加聚反应.
 ;
; (只要求写出其中一种同分异构体)
(只要求写出其中一种同分异构体) 经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为
经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为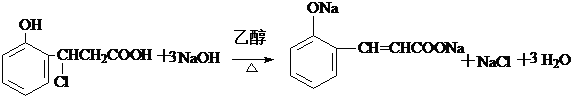 或
或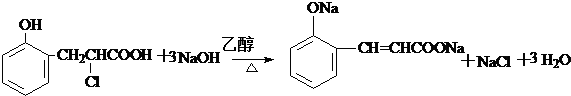 .
. .
.