题目内容
18.用电子式表示形成过程:(1)用电子式表示H2O的形成过程
 .
.(2)用电子式表示MgCl2的形成过程
 .
.
分析 (1)氢原子和氧原子之间以共用电子对而形成水分子;
(2)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到.
解答 解:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,
,
故答案为: ;
;
(2)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查电子式书写,难度不大,应判断化学式中,原子间的化学键类型,再用电子式写出其形成过程.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
8.下列说法中正确的是( )
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
9.能发生消去反应,且生成物中存在同分异构体的是( )
| A. | 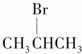 | B. | 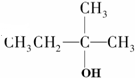 | C. | 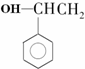 | D. | CH3Cl |
10.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
【实验一】根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸受热分解的产物中含有CO2和CO(部分夹持仪器和加热装置省略).
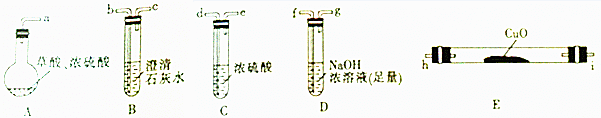
(1)用字母表示接口的正确连接顺序:a→b→c→f→g→d→e→h→i→b→c(部分装置可重复使用).
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
(3)利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”或“E”,下同)装置,后加热E装置.
【实验二】利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案.
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5(或5:2).
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
【实验三】H2C2O4溶液浓度的测定.
某同学取一定量草酸晶体配置成100mL溶液,取25.00mL溶液于锥形瓶中,然后用0.10mol•L-1的KMnO4标准溶液滴定该溶液,到达滴定终点时共消耗KMnO4标准溶液24.00mL.
(5)①KMnO4标准溶液应用酸式(填“酸式”或“碱式”)滴定管盛装,滴定终点时的现象是溶液变为紫红色且30s内不变色.
②该同学配制的H2C2O4溶液的物质的量浓度为0.24mol•L-1.
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O.草酸钙和草酸氢钙均为白色不溶物 |

(1)用字母表示接口的正确连接顺序:a→b→c→f→g→d→e→h→i→b→c(部分装置可重复使用).
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
(3)利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”或“E”,下同)装置,后加热E装置.
【实验二】利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
【实验三】H2C2O4溶液浓度的测定.
某同学取一定量草酸晶体配置成100mL溶液,取25.00mL溶液于锥形瓶中,然后用0.10mol•L-1的KMnO4标准溶液滴定该溶液,到达滴定终点时共消耗KMnO4标准溶液24.00mL.
(5)①KMnO4标准溶液应用酸式(填“酸式”或“碱式”)滴定管盛装,滴定终点时的现象是溶液变为紫红色且30s内不变色.
②该同学配制的H2C2O4溶液的物质的量浓度为0.24mol•L-1.
7.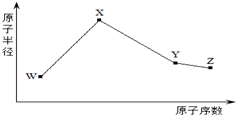 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)还有一种离子与NH4+具有相同的质子、电子数目,该离子的化学式为H3O+.
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)已知W的单质与气体B在一定条件下可形成气体A,即:
W2(g)+3B(g)?2A(g)△H=-92.4 kJ?mol-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
①W2的平均反应速率v(0min~10min)/v(10min~20min)=$\frac{1}{2}$;
②反应在第10min改变了反应条件,改变的条件可能是ab;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度.
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)还有一种离子与NH4+具有相同的质子、电子数目,该离子的化学式为H3O+.
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)已知W的单质与气体B在一定条件下可形成气体A,即:
W2(g)+3B(g)?2A(g)△H=-92.4 kJ?mol-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第10min改变了反应条件,改变的条件可能是ab;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度.
8.已知柠檬醛的结构简式为: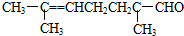 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )
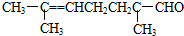 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
 (1)BCl3的分子构型sp2.第一电离能介于B、N之间的第二周期元素有3种.写出与BCl3结构相同的一种等电子体NO3-或CO32-(写离子).
(1)BCl3的分子构型sp2.第一电离能介于B、N之间的第二周期元素有3种.写出与BCl3结构相同的一种等电子体NO3-或CO32-(写离子).