题目内容
6.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况设计了如图1所示装置进行有关实验: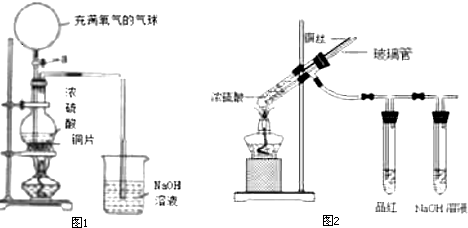
(1)先关闭活塞a,将44.8g铜片和5OmL18mol/L的浓硫酸放在圆底烧瓶中,烧杯中放入300mL lmol/L的NaOH溶液,加热烧瓶,当反应结束时发现烧瓶中还有铜片剩余,再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失.
写出上述过程中烧瓶内发生反应的化学方程式:
打开活塞a之前Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
打开活塞a之后2Cu+2H2SO4+O2=2CuSO4+2H2O;
(2)另一组的同学们设计出如图2的装置进行铜与浓H2SO4反应并检验所产生气体的性质,试指出图2中使用铜丝的优点可通过上下移动铜丝使之与浓硫酸接触或脱离而控制反应的进行或停止,装置中玻璃管的作用为可以防止倒吸、指示后续装置中是否发生堵塞、实验结束时刻通入空气排出装置中二氧化硫从而防止污染(只要求写出一条即可),实验完成后,应如何操作才不会造成S02的污染先通入足量的空气,排出装置中的二氧化硫后再拆卸装置;
(3)假定从气球中通入标准状况下5.6L的氧气时,铜片完全溶解且无氧气逸出,生成的气体全部被烧杯中的NaOH溶液完全吸收,则生成的Na2SO3的质量为25.2g.
分析 (1)打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O;
(2)使用铜丝可以通过与浓硫酸的接触或脱离控制反应;
二氧化硫有毒不能直接排空,通过空气排出装置中二氧化硫;
实验完成后,应将二氧化硫完全排出实验装置,使其完全与NaOH溶液反应;
(3)在整个反应过程中,Cu失去电子数等于SO42-、O2得到的电子数,根据转移电子相等计算生成SO2的物质的量,再根据S原子守恒计算m(Na2SO3).
解答 解:(1)打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
(2)可通过上下移动铜丝使之与浓硫酸接触或脱离而控制反应的进行或停止;
二氧化硫有毒不能直接排空,通过玻璃管向装置中通入空气排出装置中二氧化硫,还可以防止倒吸且能指示装置中是否发生堵塞;
实验完成后,为防止污染大气,应先通入足量的空气,排出装置中的二氧化硫,然后再拆卸装置,
故答案为:可通过上下移动铜丝使之与浓硫酸接触或脱离而控制反应的进行或停止;可以防止倒吸、指示后续装置中是否发生堵塞、实验结束时刻通入空气排出装置中二氧化硫从而防止污染;先通入足量的空气,排出装置中的二氧化硫后再拆卸装置;
(3)在整个反应过程中,Cu失去电子数等于SO42-、O2得到的电子数,n(Cu)=$\frac{44.8g}{64g/mol}$=0.7mol,n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据转移电子相等n(SO2)=$\frac{0.7mol×2-0.25mol×4}{6-4}$=0.2mol,再根据S原子守恒得n(SO2)=n(Na2SO3)=0.2mol,m(Na2SO3)=0.2mol×126g/mol=25.2g,
故答案为:25.2.
点评 本题以铜和浓硫酸反应实验为载体考查性质实验方案设计,涉及氧化还原反应计算、实验操作、化学方程式的书写等知识点,明确实验原理是解本题关键,难点是确定各个装置作用,易错点是化学用语的正确使用,题目难度不大.


| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
| A. | 相同温度下,0.02 mol•L-1的醋酸溶液与0.01 mol•L-1的醋酸溶液中的c(H+)之比小于2:1 | |
| B. | 相同温度下,0.1 mol•L-1 (NH4)2SO4溶液与0.1 mol•L-1NH4NO3溶液中c(NH4+)之比大于2:1 | |
| C. | 在0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 | |
| D. | 40℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2:1 |
| A. | CH3Cl | B. | CCl4 | C. | CH2Cl2 | D. | CHCl3 |
 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
Y极:4H2O+2O2+8e-=8OH-.
下列关于此燃料电池的说法中,错误的是( )
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
 )结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OH•HCl═4FeCl2+N2O↑+6HCl+H2O
)结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OH•HCl═4FeCl2+N2O↑+6HCl+H2O .
. .
.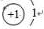 ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键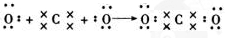 .
.