题目内容
7. W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)还有一种离子与NH4+具有相同的质子、电子数目,该离子的化学式为H3O+.
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)已知W的单质与气体B在一定条件下可形成气体A,即:
W2(g)+3B(g)?2A(g)△H=-92.4 kJ?mol-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第10min改变了反应条件,改变的条件可能是ab;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度.
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为14,中子数为7,质子数为14-7=7,故W为氮元素;X的离子与NH4+具有相同的质子、电子数目,X的质子数为11,故X为Na元素;由图可知,X、Y、Z的原子序数依次增大,都处于第三周期,Y的氧化物均能导致酸雨的形成,故Y为硫元素;Z的非金属性在同周期主族元素中最强,故Z为Cl元素,
(1)Y为硫元素,核外有三个电子层,最外层有6个电子;
(2)NH4+具有11个质子各10个电子,所此可找出与NH4+具有相同的质子、电子数目的微粒为水合氢离子;
(3)使酚酞溶液变红的气体A应为氨气,Na3N水解生成氢氧化钠和氨气;
(4)①根据v=$\frac{△c}{△t}$,由于0min~10min和10min~20min时间段相同,所以速率之比就等于浓度变化量之比;
②根据表中的数据,在第10min时反应中各物质浓度的变化量之比等于化学计量数之比,但反应速率变快,据此判断.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为14,中子数为7,则W质子数=14-7=7,故W为氮元素;X的离子与NH4+具有相同的质子、电子数目,含有10个质子、10个电子,由图可知,X的原子序数大于氮元素,可推知X为Na;W与Y的氧化物均能导致酸雨的形成,结合原子序数,可推知Y为硫元素;Z的非金属性在同周期主族元素中最强,结合原子序数可知,Z为Cl元素,
(1)Y为硫元素,在周期表中的位置是:第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)还有一种离子与NH4+具有相同的质子、电子数目,该离子的化学式为H3O+,故答案为:H3O+;
(3)Na3N遇水可释放出使酚酞溶液变红的气体A,则A为NH3,发生水解反应,同时生成NaOH,该反应化学方程式是:Na3N+3H2O=NH3↑+3NaOH,
故答案为:Na3N+3H2O=NH3↑+3NaOH;
(4)已知W的单质与气体B在一定条件下可形成气体A,即N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,
①N2的平均反应速率$\frac{v(0min-10min)}{v(10min-20min)}$=$\frac{4mol/L-3.8mol/L}{3.8mol/L-3.4mol/L}$=$\frac{1}{2}$,故答案为:$\frac{1}{2}$;
②由表中数据可知,10min~20min的速率比0min~10min速率快,10min时反应未到达平衡,反应向正反应进行,20min与10min相比,W2、B、A的浓度变化量为分别为0.2mol/L、0.6mol/L、0.4mol/L,等于化学计量数之比,故不可能为增大某一物质浓度,增大压强反应混合物的浓度都应增大,W2、B 浓度降低,故不可能为增大压强,故10min时改变条件应是更新了催化剂或升高温度加快反应速率,
故答案为:ab.
点评 本题考查位置结构性质关系、化学反应速率计算、化学平衡的影响因素等,难度中等,(4)中②注意根据浓度变化结合外界条件影响解答,增大压强为易错点,只考虑速率加快,容易忽略浓度变化.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案Y极:4H2O+2O2+8e-=8OH-.
下列关于此燃料电池的说法中,错误的是( )
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
| A. | 鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 | |
| B. | 检验酒精中的少量水:向酒精中加入足量生石灰 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如右图所示的实验装置 |
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 在酸性条件下不水解 | D. | 在一定条件下可以发生加成反应 |
| A. | 2.24L CO2中含有的原子数为0.3NA | B. | 20g D2O所含的中子数为10NA | ||
| C. | 16g CH4中含C-H键数目为NA | D. | 1 mol 氦气含有的原子数为2NA |
 )结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OH•HCl═4FeCl2+N2O↑+6HCl+H2O
)结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OH•HCl═4FeCl2+N2O↑+6HCl+H2O .
. .
. ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键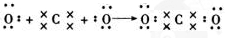 .
.