题目内容
10.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O.草酸钙和草酸氢钙均为白色不溶物 |
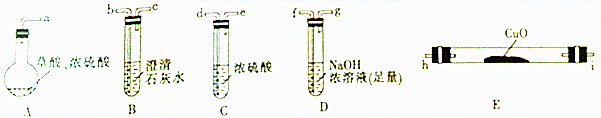
(1)用字母表示接口的正确连接顺序:a→b→c→f→g→d→e→h→i→b→c(部分装置可重复使用).
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
(3)利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”或“E”,下同)装置,后加热E装置.
【实验二】利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
【实验三】H2C2O4溶液浓度的测定.
某同学取一定量草酸晶体配置成100mL溶液,取25.00mL溶液于锥形瓶中,然后用0.10mol•L-1的KMnO4标准溶液滴定该溶液,到达滴定终点时共消耗KMnO4标准溶液24.00mL.
(5)①KMnO4标准溶液应用酸式(填“酸式”或“碱式”)滴定管盛装,滴定终点时的现象是溶液变为紫红色且30s内不变色.
②该同学配制的H2C2O4溶液的物质的量浓度为0.24mol•L-1.
分析 (1)二氧化碳能使澄清的石灰水变浑浊,CO检验还原性,能还原黑色的CuO,生成的二氧化碳用澄清的石灰水检验,因为CO和CuO反应生成二氧化碳,所以应该先检验二氧化碳后检验CO;
(2)加热时草酸易挥发,草酸和氢氧化钙反应生成草酸氢钙沉淀;
(3)一氧化碳和氧气反应在一定范围内易产生爆炸,为防止产生安全事故发生,应先制取气体,用生成的气体除去装置中的氧气;
(4)①高锰酸钾和草酸反应方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,为了观察到紫色褪去,草酸应该稍微过量;
②探究温度对化学反应速率影响,这两组实验应该只有温度一个变量,其余条件都相同;
探究反应物浓度对化学反应速率影响的两组实验应该只有反应物浓度一个变量,其余条件都相同;
(5)①酸性溶液只能用酸式滴定管盛放;
滴定终点现象为溶液变为紫红色且30 s内不变色;
②根据高锰酸钾和草酸之间的关系式计算草酸物质的量浓度.
解答 解:(1)为证明草酸的受热分解产物中含有CO2和CO,先将混合气体通入澄清的石灰水检验CO2,如果澄清的石灰水变浑浊,则证明含有CO2气体,再用NaOH溶液吸收CO2,再将洗气后的气体进行干燥,然后将气体再通过黑色的CuO装置,CO和黑色的CuO反应生成Cu和CO2,再用澄清的石灰水检验CO2是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有CO,注意洗气装置、干燥装置中的导气管应该是“长进短出”,所以其排列顺序是a→b→c→f→g→d→e→h→i→b→c,
故答案为:a→b→c→f→g→d→e→h→i→b→c;
(2)草酸加热100℃开始升华,157℃时开始分解,草酸钙和草酸氢钙均为白色不溶物,加热时草酸易挥发,生成的碳氧化物中含有草酸,草酸和氢氧化钙反应生成草酸氢钙沉淀,从而干扰实验现象,为防止干扰实验,在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管),
故答案为:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管);
(3)一氧化碳和氧气反应在一定范围内易产生爆炸,为防止产生安全事故发生,应先制取气体,用生成的气体除去装置中的氧气,所以应先加热A后加热E,
故答案为:A;E;
(4)①高锰酸钾和草酸反应方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,为了观察到紫色褪去,草酸应该稍微过量,所以n(H2C2O4):n(KMnO4)≥2.5,
故答案为:2.5(或5:2);
②探究温度对化学反应速率影响,这两组实验应该只有温度一个变量,其余条件都相同,所以应该是II和III;
探究反应物浓度对化学反应速率影响的两组实验应该只有反应物浓度一个变量,其余条件都相同,所以应该是I和II;
故答案为:Ⅱ和Ⅲ;I和Ⅱ;
(5)①酸性溶液只能用酸式滴定管盛放,酸性高锰酸钾溶液呈酸性,所以应该用酸式滴定管盛放;
滴定终点现象为溶液变为紫红色且30 s内不变色,
故答案为:酸式;溶液变为紫红色且30 s内不变色;
②设草酸的物质的量浓度是xmol/L,
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5mol 2mol
0.025xmol (0.10×0.024)mol
5mol:2mol=0.025xmol:(0.10×0.024)mol
x=$\frac{(0.10×0.024)mol×5mol}{2mol×0.025mol}$=0.24,
故答案为:0.24 mol•L-1.
点评 本题考查探究物质的组成及含量测定、化学反应速率影响因素等知识点,综合性较强,明确实验原理是解本题关键,难点是物质检验先后顺序,同时考查学生实验操作能力及思维的缜密性,注意(3)题酒精灯点燃先后顺序,为易错点.

| A. | 一个小黑点表示一个电子 | B. | 表示电子运动的轨迹 | ||
| C. | 电子在核外空间出现机会的多少 | D. | 黑点的多少表示电子个数的多少 |
| A. | CH3Cl | B. | CCl4 | C. | CH2Cl2 | D. | CHCl3 |
| A. | 乙酸乙酯和油脂均能发生水解反应生成醇 | |
| B. | 丙烯与氯气只能发生加成反应 | |
| C. | 溴乙烷与氢氧化钠的水溶液可反应生成乙烯 | |
| D. | 苯可以使酸性KMnO4溶液褪色 |
Y极:4H2O+2O2+8e-=8OH-.
下列关于此燃料电池的说法中,错误的是( )
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 在酸性条件下不水解 | D. | 在一定条件下可以发生加成反应 |
| A. | NH3,H2,C4H10? | B. | PCl3,CO2,H2SO4 | C. | SO2,SiO2,P2O5? | D. | CCl4,Na2S,H2O2 |
 .
. .
.