题目内容
16.(1)已知肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312kJ的热量,写出该反应的热化学方程式N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol(2)已知每千克氢气在常温常压下燃烧约放出热量1.43×105kJ,每千克汽油燃烧约放出热量4.6×104kJ,氢气被公认为是21世纪替代矿物燃料的理想能源,氢气作为能源的优点有:来源丰富,单位质量放热多,生成物无污染.
分析 (1)根据题中数据计算出该反应的焓变,然后写出反应的热化学方程式,注意要标注物质的聚集状态;
(2)根据氢气的来源、性质和燃烧的产物来回答.
解答 解:(1)在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312KJ的热量,则1mol液态肼完全反应生成氮气和水蒸气放出的热量为:312kJ×2=624kJ,该反应的热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol,
故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;
(2)氢气主要来源于水,在自然界中储量极为丰富;单位质量的氢燃烧时释放的热量大;燃烧产物为水,不产生污染;所以氢气作为能源的三个主要优点:来源丰富;单位质量放热多;生成物无污染;
故答案为:来源丰富,单位质量放热多,生成物无污染.
点评 本题考查了热化学方程式的书写以及氢气作为能源的主要优点,根据题中信息,结合氢气的性质分析,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
6.镭是元素周期中第七周期ⅡA族元素,下列关于镭的性质的描述中,不正确的是( )
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 硫酸盐难溶于水 | D. | 镭比钙的金属性强 |
7.以下这些结构简式,书写规范正确的是( )
| A. | 乙醛:CH3COH | B. | 新戊烷:(CH3)4C | C. | 聚氯乙烯: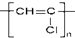 | D. | 三硝基甲苯: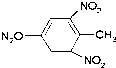 |
4.下列化学式只表示一种物质分子组成的是( )
| A. | C3H8 | B. | C2H6O | C. | C | D. | NaCl |
11.有关下列物质分子结构特征描述正确的是( )
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. | 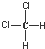 和 和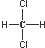 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
1.下列叙述中,不正确的是( )
| A. | C5H12的一种同分异构体只能生成一种一氯代物 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子不可能都在一条直线上 | |
| D. | 75%(体积分数)的乙醇溶液常用于医疗消毒 |
8.有关电化学知识的描述正确的是( )
| A. | 由于CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池 | |
| B. | 工业上冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| D. | 理论上说,不能自发进行的氧化还原反应都可设计成原电池 |
5.${\;}_{92}^{235}$U是一种重要的核燃料,其中“92”是指该原子的( )
| A. | 中子数 | B. | 质子数 | C. | 电子数 | D. | 质量数 |
6.下列各项中表达正确的是( )
| A. | N2的结构式: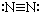 | B. | 钠离子电子式: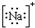 | C. | HCl的电子式: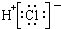 | D. | H-的结构示意图: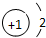 |