题目内容
17.(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.①氢气燃烧热值高.实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量.则表示H2燃烧热的热化学方程式是B
A.H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=+285.8kJ/mol
B.H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
C.H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=+285.8kJ/mol
D.H2+$\frac{1}{2}$O2=H2O△H=-285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景.氢氧燃料电池中,发生还原反应的物质是氧气(填“氢气”或“氧气”).
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,反应达到平衡后,升高温度则反应速率增大(填“增大”或“减小”);平衡将向逆反应方向(填“正反应方向”或“逆反应方向”)移动.
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag.请回答下列问题:
①该电池的负极材料是Zn;电池工作时,阳离子向正极(填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为 ZnO+C$\frac{\underline{\;高温\;}}{\;}$Zn+CO↑,此法属B(填选项字母代号).
A.电解法 B.热还原法 C.热分解法
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液 (B) 0.1mol/LNH4Cl溶液
①溶液(A)的pH=7(填“>”、“<”或“=”);
②溶液(B)呈酸性(填“酸”、“碱”或“中”),升高温度可以促进(填“促进”或“抑制”)NH4Cl的水解.
分析 (1)①依据1 mol H2完全燃烧生成液态水,放出285.8 kJ热量对应来分析;
②氢氧燃料电池中,氧气得电子发生还原反应;
③根据合成氨反应的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol为放热反应,所以升高温度则反应速率增大,平衡将向吸热反应方向移动;
(2)①负极上失电子发生氧化反应,原电池中阳离子向正极移动;
②根据反应方程式判断;
(3)强酸强碱盐在溶液中不水解,溶液显中性,强酸弱碱盐在溶液中水解,溶液显酸性,升高温度促进盐的水解.
解答 解:(1)①1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式应为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,故答案为:B;
②氢氧燃料电池中,氧气得电子发生还原反应;故答案为:氧气;
③因为合成氨反应的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol为放热反应,所以升高温度则反应速率增大,平衡将向吸热反应方向即逆反应方向移动,故答案为:增大;逆反应方向;
(2)①负极上失电子发生氧化反应,根据电池总反应为Zn+Ag2O═ZnO+2Ag可知,Zn失电子为负极,原电池中阳离子向正极移动,故答案为:Zn;正极;
②闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,反应的化学方程式为ZnO+C$\frac{\underline{\;高温\;}}{\;}$Zn+CO↑,此反应中C作还原剂在高温条件下还原ZnO,属于热还原法,
故答案为:B;
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液; (B) 0.1mol/LNH4Cl溶液;
①溶液(A)为强酸强碱盐在溶液中不水解,溶液显中性,pH=7,故答案为:=;
②溶液(B)为强酸弱碱盐在溶液中水解,溶液显酸性,升高温度促进NH4Cl的水解,故答案为:酸;促进.
点评 本题考查了热化学方程式书写,化学平衡移动原理,原电池的原理及其盐类水解等,比较综合,题目难度中等.

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 乙醛:CH3COH | B. | 新戊烷:(CH3)4C | C. | 聚氯乙烯: | D. | 三硝基甲苯: |
| A. | 由于CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池 | |
| B. | 工业上冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| D. | 理论上说,不能自发进行的氧化还原反应都可设计成原电池 |
| A. | 中子数 | B. | 质子数 | C. | 电子数 | D. | 质量数 |
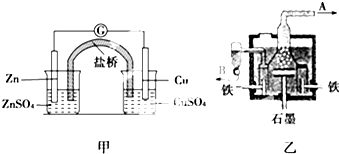
| A. | 甲装置中锌为负极,发生氧化反应,SO42-向铜极移动 | |
| B. | 乙装置中B是氯气出口,A是钠出口 | |
| C. | 乙装置中铁极为阳极,石墨为阴极 | |
| D. | 甲装置中的反应是自发反应,有化学能转化为电能;乙装置中的反应是非自发反应,有电能转化为化学能 |
| A. | CuSO4 | B. | HCl | C. | Na2SO4 | D. | KCl |
| A. | N2的结构式: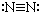 | B. | 钠离子电子式: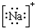 | C. | HCl的电子式: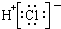 | D. | H-的结构示意图: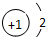 |
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |