题目内容
18.下列事实不能说明氯元素比硫元素非金属性强的是( )| A. | Cl2能与H2S反应生成S | |
| B. | 溶于水时HCl是强酸,H2S是弱酸 | |
| C. | 受热时H2S能分解,HCl则不能 | |
| D. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断.
解答 解:A.元素的非金属性越强,对应单质的氧化性越强,氯气与H2S能发生置换反应,说明氯气的氧化性大于S,元素的非金属性Cl大于S,故A正确;
B.不能根据氢化物的水溶液的酸性强弱比较非金属性,例如HI的酸性比HCl强,但非金属性Cl>I;虽硫化氢的酸性比盐酸弱,但非金属性Cl>S,故B错误;
C.元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,可说明氯元素的非金属性比硫元素强,故C正确;
D.元素的非金属性越强,对应的单质的氧化性越强,在一定条件下,Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明Cl2的氧化性大于S,则Cl的非金属性强,故D正确.
故选B.
点评 本题考查非金属性的判断,题目难度不大,注意非金属性的递变规律以及比较非金属性的角度.

练习册系列答案
相关题目
8.有关电化学知识的描述正确的是( )
| A. | 由于CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池 | |
| B. | 工业上冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| D. | 理论上说,不能自发进行的氧化还原反应都可设计成原电池 |
9.用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )
| A. | CuSO4 | B. | HCl | C. | Na2SO4 | D. | KCl |
6.下列各项中表达正确的是( )
| A. | N2的结构式: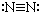 | B. | 钠离子电子式: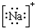 | C. | HCl的电子式: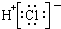 | D. | H-的结构示意图: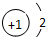 |
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |
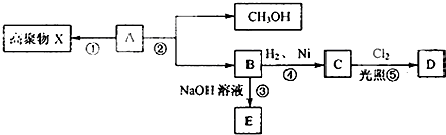 图所示的变化:
图所示的变化: CH2=CHCOOH+CH3OH.
CH2=CHCOOH+CH3OH. 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.