题目内容
1.下列所描述的二氧化硫的一些化学性质中,体现二氧化硫作为还原剂的是( )| A. | 通入溴水溶液使溴水褪色 | B. | 通入品红溶液中,使品红褪色 | ||
| C. | 溶于水形成不稳定的亚硫酸 | D. | 与碱液反应生成亚硫酸盐 |
分析 二氧化硫作还原剂,说明二氧化硫在反应中硫元素失电子化合价升高,据此分析解答.
解答 解:A.SO2+Br2+2H2O═H2SO4+2HBr,二氧化硫中硫元素失电子化合价升高,为还原剂,故A正确;
B.二氧化硫能使品红溶液褪色,说明二氧化硫具有漂白性,故B错误;
C.二氧化硫和水反应生成亚硫酸,该反应中各元素化合价不变,为非氧化还原反应,故C错误;
D.二氧化硫与碱液反应生成亚硫酸盐,该反应中各元素化合价不变,为非氧化还原反应,故D错误;
故选A.
点评 本题考查了二氧化硫的性质,根据二氧化硫中硫元素化合价是否变化及如何变化来分析解答,注意二氧化硫和品红溶液的反应中,硫元素化合价不变,为易错点.

练习册系列答案
相关题目
11.有关下列物质分子结构特征描述正确的是( )
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. |  和 和 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
9.用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )
| A. | CuSO4 | B. | HCl | C. | Na2SO4 | D. | KCl |
16.造成大气污染的SO2主要来源于( )
| A. | 自然界含硫化合物的分解和氧化 | B. | 火山喷发 | ||
| C. | 工厂排出的废气 | D. | 大量燃烧含硫燃料 |
6.下列各项中表达正确的是( )
| A. | N2的结构式: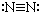 | B. | 钠离子电子式: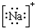 | C. | HCl的电子式: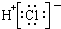 | D. | H-的结构示意图: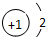 |
 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.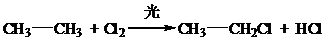 、取代反应
、取代反应 、取代反应.
、取代反应.