题目内容
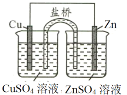
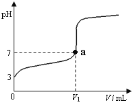
【题目】如图所示,下列分析错误的是( )
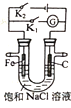
A.只闭合K2,该装置将电能转化为化学能
B.只闭合K1,石墨棒周围溶液pH逐渐升高
C.只闭合K2,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.只闭合K1,Fe电极发生反应:Fe﹣2e﹣=Fe2+
【答案】C
【解析】
A.只闭合K2,形成电解池,电解池将电能转化为化学能,选项A正确;
B.只闭合K1,形成原电池,发生吸氧腐蚀,石墨作正极,电极反应式为O2+4e﹣+2H2O=4OH﹣,即石墨棒周围溶液pH逐渐升高,选项B正确;
C.只闭合K2,形成电解池,Fe作阴极,阴极上发生得电子的还原反应,所以铁棒得到保护,属于外加电流的阴极保护法,选项C错误;
D.只闭合K1,形成原电池,Fe作负极,发生失去电子的氧化反应,电极反应式为Fe﹣2e﹣=Fe2+,选项D正确;
答案选C。

 口算题卡北京妇女儿童出版社系列答案
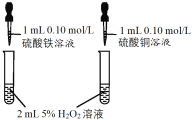
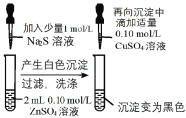
口算题卡北京妇女儿童出版社系列答案【题目】CuSO4溶液是实验室中常用试剂。下列与CuSO4溶液有关实验的操作和结论都一定正确的是
选项 | A | B | C | D |
实验操作 |
前者产生气泡更快 |
|
Cu片上发生还原反应 |
蒸发CuSO4溶液 |
结论 | Fe3+催化效果好于Cu2+ | Ksp(CuS) < Ksp(ZnS) | Cu片为正极反应物 | 可获得胆矾晶体 |
A.AB.BC.CD.D
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a