题目内容
【题目】CuSO4溶液是实验室中常用试剂。下列与CuSO4溶液有关实验的操作和结论都一定正确的是
选项 | A | B | C | D |
实验操作 |
前者产生气泡更快 |
|
Cu片上发生还原反应 |
蒸发CuSO4溶液 |
结论 | Fe3+催化效果好于Cu2+ | Ksp(CuS) < Ksp(ZnS) | Cu片为正极反应物 | 可获得胆矾晶体 |
A.AB.BC.CD.D
【答案】B
【解析】
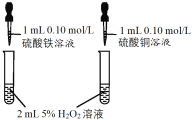
A.等体积等物质的量浓度的硫酸铁和硫酸铜加入等体积等浓度的双氧水溶液中,前者产生气泡更快,由于两溶液中硫酸根的浓度不同,因此不能说明Fe3+催化效果好于Cu2+,可能是硫酸根的催化作用,故A错误;
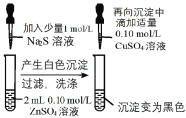
B.在一定量硫酸锌溶液中加入少量硫化钠溶液,生成ZnS白色沉淀,过滤洗涤后,再向沉淀中加入适量硫酸铜溶液,沉淀变成黑色,说明ZnS转化为CuS黑色沉淀,说明Ksp(CuS) < Ksp(ZnS),故B正确;
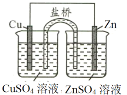
C.在该锌铜原电池中,锌为负极,铜为正极,正极Cu片本身不是反应物,铜片上发生还原反应,电极反应式为Cu2++2 e-=Cu,故C错误;
D.胆矾晶体受热容易失去结晶水,蒸发CuSO4溶液不一定得到胆矾晶体,应该冷却饱和的硫酸铜溶液,可以得到胆矾晶体,故D错误;
故选B。

 名校课堂系列答案
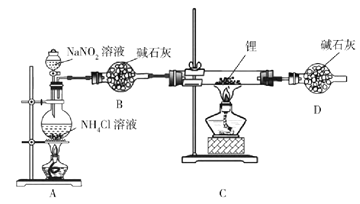
名校课堂系列答案【题目】为探究Na与CO2反应产物,某化学兴趣小组按如图装置进行实验。己知:CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
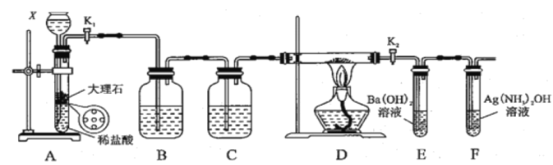
回答下列问题:
(1)写出A中反应的离子方程式__________;
(2)仪器X的名称是_______,B中的溶液为_________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是_____(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊 e.称量硬质玻璃管
f.冷却到室温重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:①钠块表面变黑,熔融成金属小球;②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③F中试管内壁有银白物质产生。产生上述②现象的原因是________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中__________; 现象:_________。 |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |