题目内容
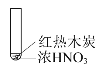
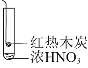
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是( )
① | ② | ③ |
|
|
|
A.由①中的红棕色气体,可推知反应还有氧气产生
B.红棕色气体表明②中木炭与浓硝酸发生了反应
C.由③可说明浓硝酸具有挥发性和强氧化性
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【答案】AC
【解析】
A.由①中的红棕色气体可知,该气体为NO2,由此可以推知:HNO3中+5价的N降低到+4价,发生还原反应,那么只有氧元素的化合价由-2价升高到0价,发生氧化反应,产生了氧气,故A正确;
B.浓硝酸与木炭加热时发生氧化还原反应,木炭被浓硝酸氧化生成二氧化碳,浓硝酸被还原成二氧化氮,二氧化氮气体为红棕色气体,但硝酸化学性质不稳定,见光或受热能分解,也会生成红棕色的二氧化氮气体,故B错误;
C.根据实验③,浓硝酸没有与木炭直接接触,若红棕色气体是硝酸分解生成的,那说明浓硝酸有挥发性,先挥发然后受热分解,若红棕色气体是木炭和浓硝酸反应生成的,也证明浓硝酸有挥发性,其次,无论红棕色气体是浓硝酸直接受热分解得到的,还是与木炭反应生成的,二氧化氮都是还原产物,可说明浓硝酸具有挥发性和强氧化性,故C正确;
D.③中红热的木炭在空气中也能生成二氧化碳,所以检测到二氧化碳并不能说明是木炭与浓硝酸发生了反应,故D错误;
故答案选AC。

【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
【题目】处理、回收利用CO是环境科学家研究的热点课题。回答下列问题:
Ⅰ.处理大气污染物
CO用于处理大气污染物N2O所发生的反应原理为:![]()
![]() 有人提出上述反应可以用“Fe+”作催化剂。
有人提出上述反应可以用“Fe+”作催化剂。
其总反应分两步进行:(1)第一步:![]() ;第二步:____ (写反应方程式)。
;第二步:____ (写反应方程式)。
(2)第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率____ 第一步反应速率(填“大于”“小于”或“等于”)。
Ⅱ.合成天然气(SNG)涉及的主要反应原理如下:
CO甲烷化: ![]()
![]()
水煤气变换: ![]()
![]()
(3)反应![]() 的△H= ___kJ/mol。
的△H= ___kJ/mol。
(4)在一恒容容器中,按照nmolCO和3nmolH2投料发生CO甲烷化反应,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,下列说法正确的是_____(填标号)。

a.温度:T1<T2<T3
b.正反应速率:v(e)>v(c)>v(b)
c.平衡常数:K(a)<K(d)<K(c)
d.平均摩尔质量:M(a)>M(b)=M(e)
(5)在恒压管道反应器中,按n(H2)︰n(CO)=3︰1通入原料气发生CO甲烷化反应,400℃、P总为100kPa时反应体系平衡组成如下表所示。
组分 | H2 | CO | CH4 | H2O | CO2 |
体积分数 | 8.50 | 1.50 | 45.0 | 44.0 | 1.00 |
则该条件下CO的总转化率α= ___。 (保留一位小数)
(6)将制备的CH4用来组成下图所示燃料电池电解制备N2O5

①阳极的电极反应为_____。
②理论上制备1molN2O5,石墨2电极消耗气体的体积为_____L(标准状况)。
【题目】某些共价键的键长数据如下表所示。试根据下表回答问题。
共价键 |
|
|
|
|
|
|
|
|
键长 | 0.154 | 0.134 | 0.121 | 0.143 | 0.123 | 0.146 | 0.122 | 0.110 |
(1)根据表中有关数据,你能推断出影响共价键键长的因素主要有哪些?_______。其影响的结果怎样?__________。
(2)通常,键能越__________,共价键越____,由该键构成的分子越稳定。