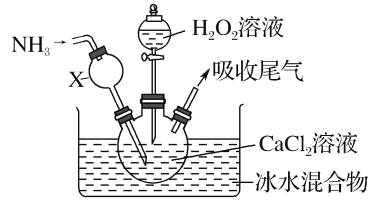
��Ŀ����
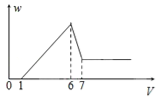
����Ŀ���ȼ��ⱥ��ʳ��ˮ��ȡNaOH�Ĺ�������ʾ��ͼ���£�
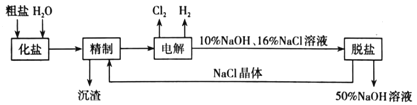
������ͼ�����������գ�
��1���Ӻ�ˮ�л�ȡ���εķ�����___��
��2���������������У�����ȥ����ˮ�е�Ca2+��Mg2+��SO42-���ɽ��еIJ����У�
A. ����
B. �ӹ���BaCl2��Һ
C. ������ϡ����
D. �ӹ���NaOH��Һ
E. �ӹ���Na2CO3��Һ
����ȷ������˳����___(����ĸ)��
�ڲ���B��Ŀ����___
�۲���C��Ŀ����___
�ܲ���D�з�����Ӧ�����ӷ���ʽ��___
�ݴ˲����е�ϡ�����ܷ���ϡ�������?____(����������������)��������___��
��3������������������Һ����Ȼ����NaCl�ķ�����___���۲쵽��������___��
��4���������������У�ͨ������Ũ������ȴ�ᾧ��___�ķ�����ȥNaCl���÷�����ԭ������ͬ�¶���NaCl��NaOH���ܽ�Ȳ�ͬ���ڸò����¶��£��ܽ�Ƚϴ����___��
��5�����������п�ѭ��ʹ�õ�������______��(�ѧʽ)��
���𰸡������ᾧ BDEAC(��BEDAC) ��ȥ��Һ��SO42- ��ȥ��Һ�е�̼���ƺ��������� Mg2++2OH-= Mg(OH)2�� �� ������NO3-���� ȡ�����������Һ�������е���ϡ�����ữ���ٵμ���������Һ �μ���������Һ�������ɫ���� ���� NaOH NaCl��NaOH
��������
(1)���ݴ���Һ�л�����ʵķ����������
(2)��ȥ����ˮ�е�Ca2+��Mg2+��SO42-��һ�����NaOH��Һ�dz�ȥþ���ӣ���BaCl2��Һ�dz�ȥ��������ӣ���Na2CO3��Һ�dz�ȥ�����Ӻ����ı����ӣ���ˣ�Na2CO3��Һһ����BaCl2��Һ֮����룬Ϊ�˲�ʹ�����ij����ܽ⣬һ��Ҫ�ڹ��˺��ټ�����ݴ˷������
(3)����������������Һ����Ȼ����NaCl��ֻ��Ҫ���麬�������Ӽ��ɣ�
(4)��ͬ�¶���NaCl��NaOH���ܽ�Ȳ�ͬ���Ȼ��Ƶ��ܽ�������¶ȱ仯�������������ܽ�Ƚϴ������¶ȵı仯�ϴݴ˷������
(5)��������ͼ���������п�ѭ��ʹ�õ����ʡ�
(1)�Ӻ�ˮ�л�ȡ���Σ�����ͨ�������ᾧ�ķ����õ����ʴ�Ϊ�������ᾧ��
(2)���������������У���ȥ����ˮ�е�Ca2+��Mg2+��SO42-������NaOH��Һ�dz�ȥþ���ӣ���BaCl2��Һ�dz�ȥ��������ӣ���Na2CO3��Һ�dz�ȥ�����Ӻ����ı����ӣ���ˣ�Na2CO3��Һһ����BaCl2��Һ֮����룬Ϊ�˲�ʹ�����ij����ܽ⣬һ��Ҫ�ڹ��˺��ټ����ᣬ��ȷ������˳����BDEAC��BEDAC���ʴ�Ϊ��BDEAC(��BEDAC)��
�ڲ���B�ӹ���BaCl2��Һ��Ϊ�˳�ȥ��������ӣ��ʴ�Ϊ����ȥ��Һ��SO42-��
�۲���C������ϡ���ᣬΪ�˳�ȥ��Һ�е�̼���ƺ��������ƣ��ʴ�Ϊ����ȥ��Һ�е�̼���ƺ��������ƣ�
�ܲ���D�ӹ���NaOH��Һ��Ϊ�˳�ȥMg2+����Ӧ�����ӷ���ʽΪMg2++2OH-= Mg(OH)2�����ʴ�Ϊ��Mg2++2OH-= Mg(OH)2����
�������ϡ�������ϡ���ᣬ������NO3-���ʣ��ʴ�Ϊ��������NO3-���ʣ�
(3)����������������Һ����Ȼ����NaCl��ֻ��Ҫ���麬�������Ӽ��ɣ�����Ϊ��ȡ�����������Һ�������е���ϡ�����ữ���ٵμ���������Һ�������ְ�ɫ������֤������NaCl���ʴ�Ϊ��ȡ�����������Һ�������е���ϡ�����ữ���ٵμ���������Һ���μ���������Һ�������ɫ������
(4)�������������У�ͨ������Ũ������ȴ�ᾧ�����˵ķ�����ȥNaCl��ԭ������ͬ�¶���NaCl��NaOH���ܽ�Ȳ�ͬ���Ȼ��Ƶ��ܽ�������¶ȱ仯�������������ܽ�Ƚϴ������¶ȵı仯�ϴ����Ƶ��������ƾ��壬�ʴ�Ϊ�����ˣ�NaOH��
(5)��������ͼ�����������п�ѭ��ʹ�õ�������NaCl��NaOH���ʴ�Ϊ��NaCl��NaOH��