题目内容
5.下列说法中不正确的是( )| A. | 化学反应的限度决定了反应物物在该条件下的最大转化率 | |
| B. | 化学反应的限度可以通过改变条件而改变 | |
| C. | 构成原电池正极和负极的材料必须是两种金属 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,则电路中有0.4mol电子通过 |
分析 A、在不同的条件下,化学反应限度不同,当达到化学反应限度时,正逆反应速率相等但不为0,反应物的浓度和生成物的浓度不再改变,当外界条件发生改变;
B、平衡发生移动,化学反应限度变化;
C、原电池的正极可以是金属也可以是非金属石墨;
D、Zn、Cu原电池中,Zn为负极,1molZn反应转移2mol电子.
解答 解:A、当达到化学反应限度时,反应物的浓度和生成物的浓度不再改变,反应物在该条件下的转化率最大,故A正确;
B、当外界条件发生改变,平衡发生移动,化学反应限度变化,故B正确;
C、构成原电池正极和负极的材料不一定是两种金属,正极可以是惰性电极石墨,故C错误;
D、13gZn是0.2mol,负极反应13gZn,电路中通过0.4mol电子,故D正确;
故选C.
点评 本题考查化学反应平衡状态的判断、以及原电池原理,题目难度不大,注意化学反应平衡状态的本质原因是正逆反应速率相等,浓度不变是外观特征.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
16.2015年4月14日“阳光动力2号”飞机抵达南京.它使用了约1.7万块高性能硅电池板,则它的动力来源是( )
| A. | 核能 | B. | 化石能源 | C. | 太阳能 | D. | 风能 |
20.关于如图所示铜锌原电池的说法正确的是( )
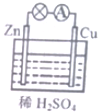

| A. | 原电池的反应本质是氧化还原反应 | B. | 电子由Cu片通过导线流向锌片 | ||
| C. | 正极反应式为Zn-2e=Zn2+ | D. | Cu为负极,Zn为正极 |
17.关于化学反应中的能量变化,下列说法中不正确的是( )
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 石墨转化为金刚石需要吸收能量,所以石墨的化学性质更稳定 |
14.1mol某烃完全燃烧可得到2molCO2;在一定条件下,1mol该烃能与1molH2发生加成反应,这种烃是( )
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | CH3CH2CHO |


 .
. (只写一种).
(只写一种).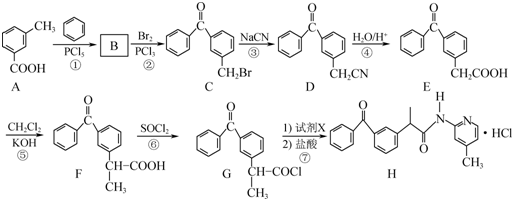
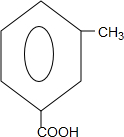 +
+ $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$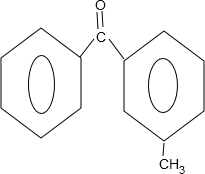 +H2O.
+H2O.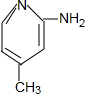 .
.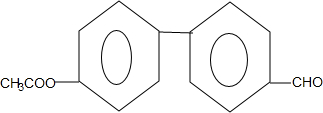 (只写一种).
(只写一种).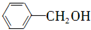 和
和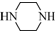 为原料制备
为原料制备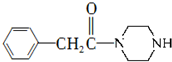 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).