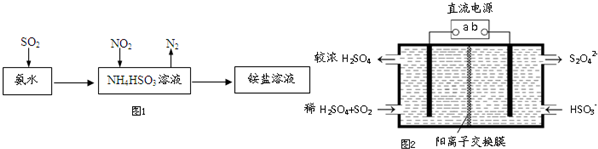
题目内容
10.下列有关元素的性质极其递变规律的表述正确的是( )①ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
②第二周期元素从左到右,最高正价从+1递增到+7
③同主族元素的简单阴离子还原性从上到下依次减弱
④同周期金属元素的化合价越高,其原子失电子能力越强
⑤族序数等于周期序数的元素一定是金属元素
⑥元素周期表中,位于金属和非金属交界线附近的元素属于过度元素
⑦Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
⑧N和As属于第VA族元素,N原子得电子能力比As原子强.
| A. | ①⑧ | B. | ①⑦⑧ | C. | ①③⑦⑧ | D. | ①③④⑧ |
分析 ①ⅠA族为H和碱金属,ⅦA族元素为非金属元素;
②第二周期元素中,O、F没有正价;
③同主族元素的简单阴离子还原性越强,对应非金属性越弱;
④同周期金属元素的化合价越高,越难失去电子.
⑤H为第一周期第IA族元素;
⑥位于金属和非金属交界线附近的元素为p区主族元素;
⑦二氧化硅与水不反应;
⑧N和As的最外层电子数均为5,属于第VA族元素,原子序数大的非金属性弱.
解答 解:①ⅠA族为H和碱金属,ⅦA族元素为非金属元素,H与卤族元素形成共价化合物,碱金属元素与卤族元素形成离子化合物,故正确;
②第二周期元素中,O、F没有正价,则第二周期元素从左到右,最高正价从+1递增到+5,故错误;
③同主族元素从上到下非金属性依次减弱,简单阴离子还原性依次增强,故错误;
④同周期金属元素的化合价越高,越难失去电子,如第三周期中,Na比Al容易失去电子,故D错误;
⑤H为第一周期第IA族元素,族序数等于周期序数,但H为非金属元素,故错误;
⑥位于金属和非金属交界线附近的元素为p区主族元素,过渡元素均为金属元素,故错误;
⑦二氧化硅与水不反应,而S、Cl的最高价氧化物都能与水反应生成相应的酸,故错误;
⑧N和As的最外层电子数均为5,属于第VA族元素,原子序数大的非金属性弱,则N原子得电子能力比As原子强,故正确;
故选A.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,注意同周期、同主族元素的性质变化规律是解答本题的关键,注意利用实例和特列分析问题,题目难度中等.

练习册系列答案
相关题目
1.常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水.然而只要给一个电火花,氢气就迅速与氧气反应生成水.反应过程中的能量变化如下图A所示. 对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )
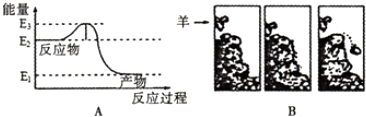

| A. | E2 | B. | E3 | C. | E2-E1 | D. | E3-E2 |
18.下列变化过程中肯定要放出热量的是( )
| A. | C+H20$\frac{\underline{\;\;△\;\;}}{\;}$C0+H2 | B. | H+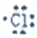 → →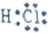 | ||
| C. | H20(1)→H20(g) | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
5.下列说法中不正确的是( )
| A. | 化学反应的限度决定了反应物物在该条件下的最大转化率 | |
| B. | 化学反应的限度可以通过改变条件而改变 | |
| C. | 构成原电池正极和负极的材料必须是两种金属 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,则电路中有0.4mol电子通过 |
15.下列实验方案设计中,可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 将稀H2SO4与BaCl2的反应设计成原电池 | |
| D. | 将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.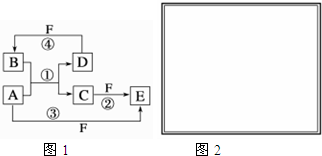
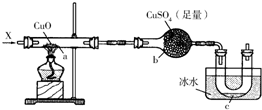 按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,(假设每个反应均完全)
按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,(假设每个反应均完全)