题目内容
17.在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.回答下列问题:
①平衡时CO的转化率为50%,该反应的化学平衡常数为1.
②427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H<0(填“>”、“=”、“<”).
分析 在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO的物质的量为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
①转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;反应前后气体的体积不变,用物质的量代替浓度代入平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算;
②由上述分析可知,800℃时该反应平衡常数K=1,而427℃时该反应的平衡常数为9.4,说明降低温度平衡正向移动,则正反应为放热反应.
解答 解:在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO的物质的量为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
①CO转化率=$\frac{0.5mol}{1mol}$×100%=50%;反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,则平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×0.5}$=1,
故答案为:50%;1;
②由上述分析可知,800℃时该反应平衡常数K=1,而427℃时该反应的平衡常数为9.4,说明降低温度平衡正向移动,则正反应为放热反应,故△H<0,
故答案为:<.
点评 本题考查化学平衡计算,难度不大,注意平衡常数只受温度影响,有利于基础知识的巩固.

| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
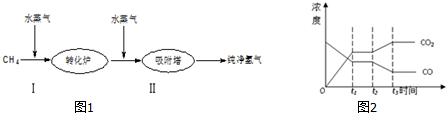
(1)第II步反应为CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,其平衡常数随温度的变化如下:
| 温度T/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)第II步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,向恒容反应器中加入下列物质发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号).
| 实验编号 | n(CO)/mol | n(H2O)/mol | n(H2)/mol | n(CO2)/mol |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
①体系的压强不再变化 ②混合气体的平均相对分子质量不再变化
③体系中各物质的浓度不再改变 ④体系的温度不再变化
⑤混合气体的密度不再变化
(4)图2表示此流程的第II步反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则图中t2时刻发生改变的条件是降低温度或增加水蒸汽的量或减少氢气的量(只写2种).
(5)若400℃时,第Ⅱ步反应生成l molH2放出的热量为 33.2kJ,第Ⅰ步反应的热化学方程式为 CH4(g)+H2O(g)═CO(g)+3H2(g)△H=-103.3kJ•mol-1.
则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-136.5kJ•mol-1.
| A. | 食盐 | B. | 植物油 | C. | 蔗糖 | D. | 酒精 |
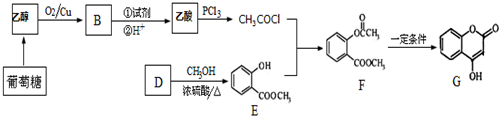
 2CH3CHO+2H2O
2CH3CHO+2H2O 
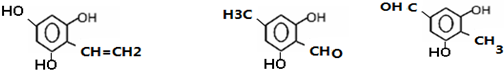 (其中一种)
(其中一种)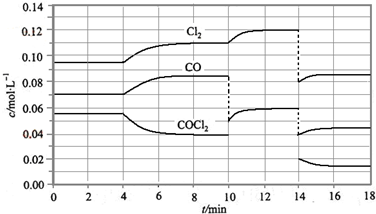
 如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线:
如图表示反应X (g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线: