题目内容
9.化学与社会、生产、生活密切相关.下列说法不正确的是( )| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 推广使用燃煤脱硫技术,防治S02对空气的污染 | |
| D. | 废旧电池中的汞、镉、铅等重金属元素对土壤和水源会造成污染 |
分析 A.“地沟油”中主要含油脂;
B.海水中获得食盐为物理变化,海水提溴、碘、Mg等需要化学变化;
C.燃煤脱硫,将二氧化硫转化为亚硫酸盐,减少排放;
D.废旧电池中的汞、镉、铅等重金属盐,均为有毒物质.
解答 解:A.“地沟油”中主要含油脂,还含有害物质,不能食用,但可用来制肥皂(碱性条件下水解)或燃油(油脂能燃烧),故A正确;
B.海水中获得食盐为物理变化,海水提溴、碘、Mg等需要化学变化,则从海水中提取物质不一定通过化学反应才能实现,故B错误;
C.燃煤脱硫,将二氧化硫转化为亚硫酸盐,减少排放,防治SO2对空气的污染,故C正确;
D.废旧电池中的汞、镉、铅等重金属盐,均为有毒物质,对土壤和水源会造成污染,则应集中回收处理,故D正确,故选B.
点评 本题考查环境污染及保护,为高频考点,侧重化学与生活、材料、资源利用的考查,注意海水中资源利用原理及二氧化硅具有导光性,题目难度不大.

练习册系列答案
相关题目
19.(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
20.1mol某有机物在稀硫酸作用下,水解生成2mol相同的物质.下列物质中:①蔗糖 ②麦芽糖 ③淀粉④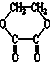 ⑤
⑤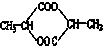 ⑥
⑥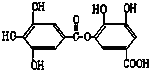 ⑦
⑦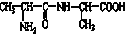 ,符合题意的物质可能是( )
,符合题意的物质可能是( )
 ⑤
⑤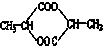 ⑥
⑥ ⑦
⑦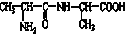 ,符合题意的物质可能是( )
,符合题意的物质可能是( )| A. | ①②⑤⑦ | B. | ②④⑤⑦ | C. | ②⑤⑥⑦ | D. | ①④⑤⑥ |
17.某同学根据原电池的构成及其原理,设计了以下几个装置,以证明铁、铜金属性强弱顺序.你认为下列现象符合客观事实的是( )
| A. | 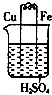 铁上有气泡 铁上有气泡 | |
| B. |  铜上有气泡 铜上有气泡 | |
| C. |  铁片上析出红色的铜 铁片上析出红色的铜 | |
| D. |  AB为导体,反应一段时间后,铁球向下倾斜 AB为导体,反应一段时间后,铁球向下倾斜 |
4.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:下列说法正确的是( )
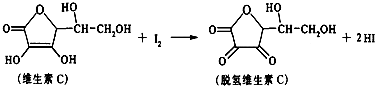
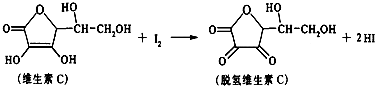
| A. | 上述反应为取代反应 | B. | 滴定时可用淀粉溶液作指示剂 | ||
| C. | 滴定时应剧烈振荡锥形瓶 | D. | 脱氢维生素C的分子式为C6H7O6 |
1.下列有关电池的说法不正确的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 原电池中,阳离子一定向负极移动 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
19.双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )
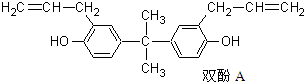

| A. | 该化合物的化学式为C20H24O2 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 该化合物的所有碳原子处于同一平面 | |
| D. | 1mol双酚A最多可与4mol Br2发生取代反应 |
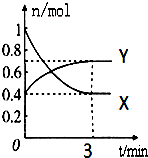 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.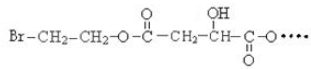
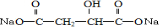 BHOCH2CH2OHC
BHOCH2CH2OHC D
D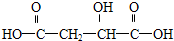
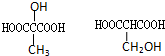
 .
.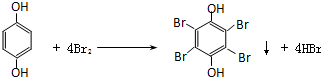 .
.