题目内容
17.某同学根据原电池的构成及其原理,设计了以下几个装置,以证明铁、铜金属性强弱顺序.你认为下列现象符合客观事实的是( )| A. | 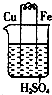 铁上有气泡 铁上有气泡 | |
| B. | 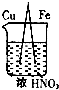 铜上有气泡 铜上有气泡 | |
| C. | 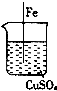 铁片上析出红色的铜 铁片上析出红色的铜 | |
| D. | 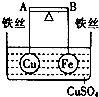 AB为导体,反应一段时间后,铁球向下倾斜 AB为导体,反应一段时间后,铁球向下倾斜 |
分析 A.该装置是原电池,Fe易失电子作负极、Cu作正极,所以Fe被腐蚀,Cu上有氢气生成;
B.该装置是原电池,Cu在该装置中易失电子作负极、Fe因为发生钝化现象作正极;
C.铁和硫酸铜发生置换反应生成Cu;
D.该装置是原电池,Fe易失电子作负极、Cu作正极,所以实验过程中Fe被腐蚀,Cu上有铜单质析出.
解答 解:A.该装置是原电池,Fe易失电子作负极生成亚铁离子进入溶液、Cu作正极,Cu电极上氢离子得电子生成氢气,故A错误;
B.该装置是原电池,Cu在该装置中易失电子作负极、Fe因为发生钝化现象作正极,则铁片上有气体生成,故B错误;
C.铁和硫酸铜发生置换反应生成Cu,所以铁片上有Cu析出,故C正确;
D.该装置是原电池,Fe易失电子作负极、Cu作正极,所以实验过程中Fe被腐蚀,Cu上有铜单质析出,导致铜球向下倾斜,故D错误;
故选C.
点评 本题以金属活动性强弱为载体考查原电池原理,明确各个电极上发生的反应是解本题关键,易错选项是B,注意铁和浓硝酸在常温下发生钝化现象,注意不能根据金属活动性强弱判断原电池正负极,为易错点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
8.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列.
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列.
| A. | ①② | B. | ②④ | C. | ①④ | D. | ②③ |
5.1mol某烃最多能和1molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和Cl2发生取代反应最多生成9molHCl,生成只含碳元素和氢元素的氯代烷,该烃可能是( )
| A. | CH3CH═CHCH2CH3 | B. | CH2═CHCH═CH2 | C. | CH2═CHCH3 | D. | CH3-CH═CH-CH3 |
12.下列有关煤、石油、天然气等资源的说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤就是碳,属于单质 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 煤的气化就是将煤在高温条件由固态转化为气态是物理变化过程 |
2.能正确表示下列反应的离子方程式是( )
| A. | 过氧化钠固体与水反应:2O${\;}_{2}^{2-}$+2H2O═4OH-+O2↑ | |
| B. | 实验室制Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
9.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 推广使用燃煤脱硫技术,防治S02对空气的污染 | |
| D. | 废旧电池中的汞、镉、铅等重金属元素对土壤和水源会造成污染 |