题目内容
18.某有机化合物X(C12H13O6Br)遇FeCl3溶液显紫色,其结构如下:
(1)X在足量的NaOH水溶液中加热反应得到A、B、C三种有机物,C中只有一种氢原子.A经盐酸酸化后得到一种称之为苹果酸的物质D,2003年11月《环球时报》美国特约记者文章:一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国,其中的主要酸性物质就是苹果酸. 写出A、B、C、D的结构简式:
A
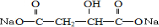 BHOCH2CH2OHC
BHOCH2CH2OHC D
D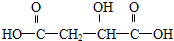
(2)写出与D属于同类的同分异构体的结构简式
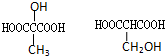
(3)两分子D通过分子间脱水可形成3种环状酯,试写出其中生成六元环状酯的化学方程式
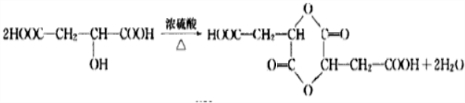 .
.(4)C经酸化后可得到E,写出E与足量浓溴水反应的化学方程式
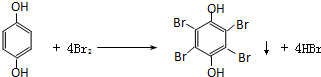 .
.
分析 X遇FeCl3溶液显紫色,说明X中有酚的结构,由X的分子式和部分结构简式可知,X部分结构简式连在苯环上,X在足量的NaOH水溶液中加热反应得到A、B、C三种有机物,C中只有一种氢原子,则C为 ,X为
,X为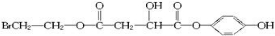 ,A经盐酸酸化后得到一种称之为苹果酸的物质D,则A为
,A经盐酸酸化后得到一种称之为苹果酸的物质D,则A为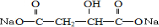 ,D为
,D为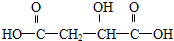 ,可知B为HOCH2CH2OH,据此解答.
,可知B为HOCH2CH2OH,据此解答.
解答 解:X遇FeCl3溶液显紫色,说明X中有酚的结构,由X的分子式和部分结构简式可知,X部分结构简式连在苯环上,X在足量的NaOH水溶液中加热反应得到A、B、C三种有机物,C中只有一种氢原子,则C为 ,X为
,X为 ,A经盐酸酸化后得到一种称之为苹果酸的物质D,则A为
,A经盐酸酸化后得到一种称之为苹果酸的物质D,则A为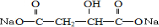 ,D为
,D为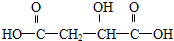 ,可知B为HOCH2CH2OH.
,可知B为HOCH2CH2OH.
(1)由上述分析可知,A为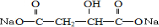 ,B为HOCH2CH2OH,C为
,B为HOCH2CH2OH,C为 ,D为
,D为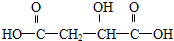 ,
,
故答案为: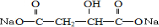 ;HOCH2CH2OH;
;HOCH2CH2OH; ;
;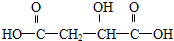 ;
;
(2)与D(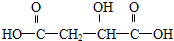 )属于同类的同分异构体的结构简式为:
)属于同类的同分异构体的结构简式为: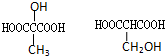 ,
,
故答案为: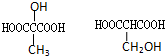 ;
;
(3)两分子D(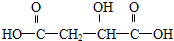 )通过分子间脱水形成环状酯,羟基可以与不同的羧基形成酯基,相互组合可以形成3种环酯,其中生成六元环状酯的化学方程式为:
)通过分子间脱水形成环状酯,羟基可以与不同的羧基形成酯基,相互组合可以形成3种环酯,其中生成六元环状酯的化学方程式为: ,
,
故答案为:3; ;
;
(4)C经酸化后可得到E为 ,与足量浓溴水反应的化学方程式为:
,与足量浓溴水反应的化学方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,根据X的结构片段、水解产物结构特点与性质进行推断,侧重考查学生分析推理能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列.
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列.
| A. | ①② | B. | ②④ | C. | ①④ | D. | ②③ |
9.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 推广使用燃煤脱硫技术,防治S02对空气的污染 | |
| D. | 废旧电池中的汞、镉、铅等重金属元素对土壤和水源会造成污染 |
13.下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法.填表(填入序号):
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)浓溴水;(7)KMnO4溶液.
C:(1)变性;(2)渗析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气;(7)盐析.
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)浓溴水;(7)KMnO4溶液.
C:(1)变性;(2)渗析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气;(7)盐析.
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②蛋白质(NaCl) | (3) | (2) |
| ③肥皂(甘油) | (1) | (7) |
| ④乙醇(水) | (4) | (3) |
| ⑤乙酸乙酯(乙酸) | (5) | (4) |
| ⑥乙烷(乙烯) | (6) | (6) |
3.下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Na+、S2-、Cl- | B. | OH-、ClO-、SO42-、S2- | ||
| C. | H+、MnO4-、Cl-、K+ | D. | K+、NO3-、Cl-、Fe2+ |
7.下列说法正确的是( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸;
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收;
③新制氯水的氧化性强于久置氯水;
④检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液中;
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水.
①氯气的性质活泼,它与氢气混合后立即发生爆炸;
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收;
③新制氯水的氧化性强于久置氯水;
④检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液中;
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水.
| A. | ①②③ | B. | ②③④ | C. | ③ | D. | ③⑤ |
9.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 若2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |