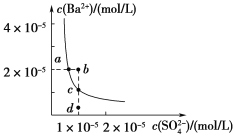
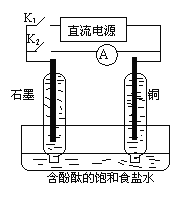
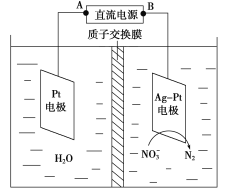
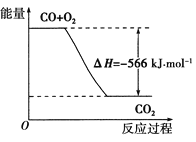
题目内容
【题目】将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
(1)写出上述过程中有关反应的离子方程式:_________、____________________。
(2)完成该反应至少需要量取10mol·L-1的浓硝酸________mL。
(3)混合气体中NO2的体积为______________L,NO的体积________L(均为标准状况下)。
【答案】Cu+4H++2NO3—===Cu2++2NO2↑+2H2O 3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O 600 22.4 22.4
【解析】
(1)发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)反应中被还原的HNO3生成NO、NO2混合气体,未被还原的硝酸生成Cu(NO3)2,由氮原子守恒可知,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2),再根据V=![]() 计算;
计算;
(3)设混合气体中NO2、NO的物质的量分别为xmol、ymol,根据电子转移守恒及二者体积列方程计算,再根据V=nVm计算各自的体积。
(1)Cu分别溶于浓硝酸、稀硝酸发生的反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,则对应的离子反应方程式为Cu+4H++2NO3—===Cu2++2NO2↑+2H2O、3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O;
(2)反应中被还原的HNO3生成NO、NO2混合气体,混合气体的物质的量=![]() =2mol,未被还原的硝酸生成Cu(NO3)2,铜的物质的量=
=2mol,未被还原的硝酸生成Cu(NO3)2,铜的物质的量=![]() =2mol,由氮原子守恒可知,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2mol×2+2mol=6mol,故需要硝酸的体积=
=2mol,由氮原子守恒可知,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2mol×2+2mol=6mol,故需要硝酸的体积=![]() =0.6L=600mL;
=0.6L=600mL;
(3)设混合气体中NO2、NO的物质的量分别为xmol、ymol,根据电子转移守恒及二者体积,可得:x+3y=2×2、x+y=2,解得x=1、y=1;故二氧化氮的体积=1mol×22.4L/mol=22.4L,NO的体积=1mol×22.4L/mol=22.4L。