��Ŀ����
����Ŀ���������������������ɴ�����Ⱦ����Ҫ���ʣ�ij����С����������о���
��1��д��SO2��g����NO2��g����Ӧ����SO3��g����NO��g�����Ȼ�ѧ����ʽ_____________��
��2����������NaOH��Һ����SO2������NaOH��Һ��ͨ��������SO2ʱ���õ�NaHSO3��Һ������ͼ��ʾװ�ã��缫��Ϊ���Ե缫����pHΪ4��7֮����,��ʹNaHSO3ת��ΪNa2S2O4������ý�Ũ�����ᣬ���ǵ绯ѧ������֮һ��
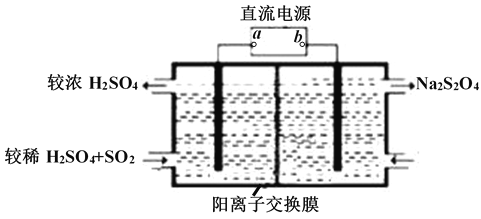
��aΪ��Դ��_______���� ������������������
�������ĵ缫��ӦʽΪ______
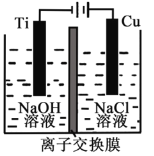
��.����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O����ӦΪ2Cu + H2O ==Cu2O + H2����װ����ͼ��ʾ�������ӽ���ĤΪ__________���ӽ���Ĥ(�����������)���õ�ص�������ӦʽΪ��____________________���Ѽ�������pH_______ (����С������)��
��.����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ���
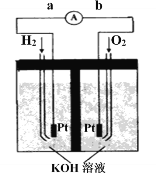
������ȼ�ϵ�ص�����ת����Ҫ��ʽ��________������ʱ��������Ϊ_______����a��b��b��a��ʾ����
�ڸ����ĵ缫��ӦʽΪ__________________��
���𰸡�SO2��g��+NO2��g��=SO3��g��+NO��g����H=-41.8kJ/mol ���� 2HSO3-+2H++2e-=S2O42-+2H2O �� 2Cu �C 2e��+ 2OH��= Cu2O + H2O ���� ��ѧ�ܡ����� b��a H2��2e��+2OH��=2H2O
��������
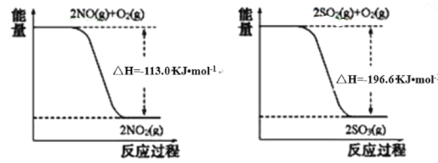
��1������������������ͼ������NO��O2��SO2��O2��Ӧ���Ȼ�ѧ����ʽ�����ݸ�˹����д��SO2��NO2��Ӧ���Ȼ�ѧ��Ӧ����ʽ��
��2������ͼ�е��أ�������Ӧ�ĵĻ��ϼ۱仯��������Կ���NaHSO3��Na2S2O4��S�Ļ��ϼ۽��ͣ�����b�Ǹ�������a��������
��.���ܷ�Ӧ����֪�����缫��Ӧʽ��TiΪ������H+�ŵ磬��Һ��pH����
��.ԭ����ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã�ȼ�ϵ����ԭ��أ���ԭ�����ʧ���ӵ�һ��Ϊ�������õ��ӵ�һ��Ϊ���������Ӿ������ɸ������ݵ�������������������������
��1����֪��ͼ��������2SO2��g��+O2��g���T2SO3��g������H=-196.6kJ/mol
��O2��g��+2NO��g���T2NO2��g������H=-113.0kJ/mol
���ݸ�˹����![]() �ɵã�SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol�������Ϊ��SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol��
�ɵã�SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol�������Ϊ��SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol��
��2����NaHSO3��Na2S2O4��S�Ļ��ϼ۽��ͣ�����b�Ǹ�������a�������������缫��ӦʽΪ��2HSO3-+2H++2e-=S2O42-+2H2O�������Ϊ��������2HSO3-+2H++2e-=S2O42-+2H2O��
��.��Ϊ�ܷ�ӦΪ��2Cu + H2O ==Cu2O + H2��������������ӦΪ��2Cu-2e-+2OH-=Cu2O+H2O, �����ӽ���ĤӦ���������ӽ���Ĥ�������缫��ӦΪ��2H2O+2e-=H2��+2OH-, Ti��Ϊ����������������Һ��pH�������Ϊ������2Cu �C 2e- + 2OH�� = Cu2O + H2O������
��.ȼ�ϵ����ԭ��أ��ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã�������ȼ�ϵ����ͨ��H2�ĵ缫�Ǹ�����H2ʧȥ���ӣ�ͨ��O2�ĵ缫��������O2�õ����ӣ����Ӿ������ɸ������ݵ�������������b����a���������Һ�Լ��ԣ����Ը�����ӦʽΪH2-2e-+2OH-=2H2O�������Ϊ����ѧ�������ܡ�b��a��H2��2e��+2OH��=2H2O��

����Ŀ���±�Ϊԭ��������������Ķ�����Ԫ��A~F�ĵ�һ��������������ݣ����еĽ���Ԫ����
������I��ev�� | A | B | C | D | E | F |
I1 | 5.2 | 7.6 | 6.0 | 11.3 | 13.6 | 14.5 |
I2 | 49.3 | 15.0 | 18.8 | 24.4 | 35.1 | 29.6 |
I3 | 71.6 | 80.1 | 28.4 | 47.9 | 54.9 | 47.4 |
I4 | 98.9 | 109.2 | 112.0 | 64.5 | 77.4 | 77.5 |
I5 | 138.3 | 141.3 | 153.7 | 392.1 | 113.9 | 97.9 |
A.A B CB.B C DC.C D ED.D E F