题目内容
【题目】在无色透明溶液中,不能大量共存的离子组是( )
A.K+、Na+、SO42-、Cl-B.K+、Na+、HCO3-、NO3-
C.Ca2+、Na+、OH-、HCO3-D.Ba2+、Na+、OH-、NO3-
【答案】C
【解析】
A.K+、Na+、SO42-、Cl-离子间不反应,且离子均为无色,故A可大量共存;
B.K+、Na+、HCO3-、NO3-离子之间不反应,且离子均为无色,故B可大量共存;
C.以上均为无色离子,但OH-、HCO3-、Ca2+结合生成沉淀和水,故C不能大量共存;
D.Ba2+、Na+、OH-、NO3-离子之间不反应,且离子均为无色,故D可大量共存;
答案选C。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。
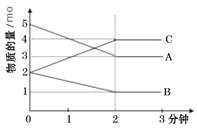
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。
【题目】如表为元素周期表的一部分,标出了A—K共十种元素所在位置。请用元素符号或化学式回答下列问题.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是______,最活泼的金属是_____。
(2)C、E、F三种元素形成的简单离子半径最小的是_______。
(3)C、K形成的化合物中化学键的类型属于________
(4)化合物C2B2的电子式为__________________;该化合物和AB2反应的化学方程式为__________________________________________。
(5)E的最高价氧化物属于________________性氧化物,它与氢氧化钠溶液反应的离子方程式为____________________________________________。
(6)D的单质在A、B形成化合物中燃烧的化学方程式为________________________。
(7)用电子式表示H与B组成的H2B型化合物的形成过程:_____________________。