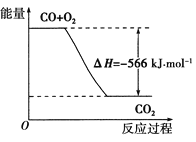
题目内容
【题目】写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量:________。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ的热量______。
【答案】N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
【解析】
(1)N2(g)与H2(g)完全反应生成1molNH3(g)放热46.1kJ热量,生成2mol氨气放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式;
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式。
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量,生成2molNH3(g),放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g) ![]() H=-92.2kJ/mol;
H=-92.2kJ/mol;
因此,本题正确答案是:N2(g)+3H2(g)=2NH3(g) ![]() H=-92.2kJ/mol;
H=-92.2kJ/mol;
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ![]() H=-1366.8kJ/mol,
H=-1366.8kJ/mol,
因此,本题正确答案是:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ![]() H=-1366.8kJ/mol。
H=-1366.8kJ/mol。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。
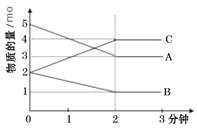
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。