题目内容
【题目】下图为直流电源电解稀Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )

A.一电极逸出无味气体,另一电极逸出刺激性气味气体
B.逸出气体的体积,a电极的大于b电极的
C.a电极附近呈红色,b电极附近呈蓝色
D.a、b电极附近均呈红色
【答案】B
【解析】
电解池中,石墨作电极,a极连接电源的负极,为电解池的阴极,b极连接电源的正极,为电解池的阳极,阳极反应式为:2H2O-4e- ═4H++O2↑,阴极反应式为: 2H2O+2e-═H2↑+2OH-,总反应为2H2O![]() 2H2↑+O2↑,电解Na2SO4溶液实质为电解水,据此解答。
2H2↑+O2↑,电解Na2SO4溶液实质为电解水,据此解答。
电解池中,石墨作电极,a极连接电源的负极,为电解池的阴极,b极连接电源的正极,为电解池的阳极,阳极反应式为:2H2O-4e- ═4H++O2↑,阴极反应式为: 2H2O+2e-═H2↑+2OH-,总反应为2H2O![]() 2H2↑+O2↑,电解Na2SO4溶液实质为电解水,
2H2↑+O2↑,电解Na2SO4溶液实质为电解水,
A. 氧气和氢气都是无色无味的气体,不可能逸出刺激性气味气体,A项错误;
B. a电极逸出的气体为氢气,b电极逸出的气体为氧气,二者关系为2H2O2,则相同条件下,气体的体积为a电极的大于b电极的,B项正确;
C. 由以上分析知,a电极是阴极,产生氢气,同时产生氢氧根离子,呈碱性,石蕊溶液呈蓝色;b电极是阳极,产生氧气,同时产生氢离子,所以b极区呈酸性,石蕊溶液呈红色,C项错误;
D. 由C项分析知,a电极附近呈蓝色,b电极附近呈红色,D项错误;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量g/100ml![]() 。
。
(1)量取10.00ml食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用___(填仪器名称)取待测白醋溶液20.00ml于锥形瓶中,向其中滴加2滴酚酞。
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。滴定终点的现象:___,停止滴定,记录NaOH溶液的终读数,计算实验所用NaOH溶液总体积记录于下表,重复滴定4次。
![]()
(4)实验记录数据(ml)
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)数据处理与讨论:
A.甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积__ml,按正确数据处理,可得市售白醋总酸量![]() __g/100ml。
__g/100ml。
B.在本实验的滴定过程中,下列操作对实验结果的影响是(填写“偏大”、“偏小”或“无影响”)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗___;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失___;
c.锥形瓶中加入待测白醋溶液后,再加少量水___。
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
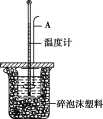
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度